题目内容
【题目】溶于海水的CO2主要以4种无机碳形式存在,其中 HCO3-占95 % ,利用图示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法正确的是
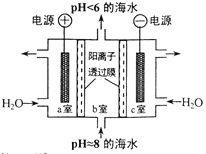
A. a 室排出的是NaOH 、Ca(OH)2等强碱性物质
B. b 室发生主要反应: 2H++ CO32-=== H2O +CO2↑
C. c室发生的反应为 2H2O-4e-===O2↑+ 4H+
D. 装置中产生的 O2和提取的 CO2的体积比约为1:4
【答案】D
【解析】
根据电解原理,写出阳极、阴极反应式,结合海水成分和阳离子交换膜的作用,分析电解池c室发生的变化,进而作出相应判断。
A项:a 室电极与电源正极相连,是电解池阳极,电极反应为2H2O-4e-===O2↑+ 4H+。H+通过阳离子交换膜进入b室,A项错误;
B项:a室生成的H+通过阳离子交换膜进入b室,与主要含碳粒子发生反应HCO3-+H+=H2O +CO2↑,B项错误;
C项:c室电极与电源负极相连,是电解池阴极,电极反应为2H2O+2e-===H2↑+ 2OH-。b室海水中阳离子通过离子交换膜进入c室,故c室排出的是NaOH 、Ca(OH)2等强碱性物质,C项错误;
D项:据阳极反应和b室反应可知,装置中产生的 O2和提取的 CO2的体积比约为1:4,D项正确。
本题选D。

练习册系列答案
相关题目