题目内容
【题目】起固氮作用的化学反应的是
A. 工业上用氮气和氢气合成氨气B. 一氧化氮与氧气反应生成二氧化氮
C. 氨气经催化氧化生成一氧化氮D. 由氨气制碳酸氢铵和硫酸铵
【答案】A
【解析】
试题氮的固定是游离态的N转化为化合态的N的方法。A.工业上用氮气和氢气合成氨气是N的单质变为化合物。正确。 B.一氧化氮与氧气反应生成二氧化氮是N的化合物的转化。错误。C.氨气经催化氧化生成一氧化氮是N的化合物的转化。错误。 D.由氨气制化肥碳酸氢铵和硫酸铵的N的化合物的转化。错误。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O![]() H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_____pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=_______(保留三位有效数字)。
③0.lmol/LNa2N2O2溶液中离子浓度由大到小的顺序为____________。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1=-159.5kJmol-1;
NH2CO2NH4(s) △H1=-159.5kJmol-1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJmol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为____________。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为___________。
②图2中能正确反应平衡常数K随温度变化关系的曲线为__________(填字母标号)。

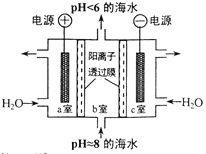
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为______________。
【题目】在一定条件下,将A和B各0.32mol充入10L恒容密闭容器中,发生反应:
A(g)+B(g)![]() 2C(g) △H<0,反应过程中测定的数据如下表,下列说法正确的是
2C(g) △H<0,反应过程中测定的数据如下表,下列说法正确的是
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A. 反应前2 min的平均速率v(C)=0.004 mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v (逆)> v (正)
C. 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol
D. 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 6.5 | 1.5 | 7.2 | 8.2 |
沉淀完全的pH | 9.9 | 3.3 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③_____等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式_____________
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为______________
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为_____________
②再加入ZnO控制反应液的pH范围为_____________
(4)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):Ksp(CdCO3)=5.2×10-12, Ksp(CdS)=3.6×10-29,Ksp(Cd(OH)2)=2.0×10-16,根据上述信息:沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=________________