题目内容
【题目】I.(1)FeCl3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是:________________________(用离子方程式表示);实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于盐酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”、“抑制”)其水解;将FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是______。
(2)测NaClO溶液的pH,可用__________________(填“广泛pH试纸”、“精密pH试纸”、“pH计”);NaClO溶液显碱性的原因是:________________________(用离子方程式表示);已知HClO的Ka=2.95×10-8,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,则NaClO溶液中通入少量的CO2,所发生的化学方程式为__________。
II.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系
A.c(Cl-)>c (NH4+)>c (H+)>c(OH-)
B.c (Cl-)>c (NH4+)>c (OH-)>c (H+)
C.c(NH4+)>c (Cl-)>c(OH-)>c (H+)
D.c (Cl-)>c (H+)>c (NH4+)>c (OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质是_______,上述四种离子浓度的大小顺序为____________(填序号);
(2)若上述关系中C是正确的,则溶质为___________________;若上述关系中D是正确的,则溶质为___________________。
(3)若该溶液是体积相等的浓盐酸和氨水混合而成,且恰好是中性,则混合前c(HCl) _______ c (NH3H2O)(大于、小于或等于)。
【答案】酸 Fe3++3H2O![]() Fe(OH)3+3H+ 抑制 Fe2O3 pH计 ClO-+H2O
Fe(OH)3+3H+ 抑制 Fe2O3 pH计 ClO-+H2O![]() HClO+OH- CO2+H2O+NaClO=NaHCO3+HClO NH4Cl ① NH4Cl 和NH3H2O NH4Cl和HCl 小于
HClO+OH- CO2+H2O+NaClO=NaHCO3+HClO NH4Cl ① NH4Cl 和NH3H2O NH4Cl和HCl 小于
【解析】
I.(1)FeCl3是强酸弱碱盐,铁离子能够水解;在配制氯化铁溶液时,需要防止氯化铁水解;水解生成的氯化氢容易挥发,据此分析解答;
(2)根据NaClO溶液具有强氧化性,结合常见的测定pH的方法解答;NaClO属于强碱弱酸盐,能够水解,据此书写水解方程式;根据HClO的Ka=2.95×10-8,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,判断出HClO、H2CO3、HCO3-的酸性强弱,结合复分解反应的原理书写方程式;
Ⅱ.任何水溶液中都有OH-、H+,结合溶液中存在OH-、H+、NH4+、Cl-四种离子,则溶质可能为NH4Cl、盐酸和氨水,利用铵根离子水解,结合溶液的酸碱性来分析解答。
(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2OFe(OH)3+2H+;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解;氯化铁水解,水解生成的氯化氢容易挥发,促进氯化铁的水解,蒸干得到氢氧化铁,灼烧得到Fe2O3,故答案为:酸;Fe3++3H2OFe(OH)3+3H+;抑制;Fe2O3;
(2) NaClO溶液具有强氧化性,不能用pH试纸测NaClO溶液的pH,应该用pH计测定NaClO溶液的pH;NaClO属于强碱弱酸盐,NaClO溶液显碱性是因为ClO-+H2O![]() HClO+OH-;根据HClO的Ka=2.95×10-8,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,可知酸性H2CO3>HClO>HCO3-,则NaClO溶液中通入少量的CO2,反应的化学方程式为CO2+H2O+NaClO=NaHCO3+HClO,故答案为:pH计;ClO-+H2O
HClO+OH-;根据HClO的Ka=2.95×10-8,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,可知酸性H2CO3>HClO>HCO3-,则NaClO溶液中通入少量的CO2,反应的化学方程式为CO2+H2O+NaClO=NaHCO3+HClO,故答案为:pH计;ClO-+H2O![]() HClO+OH-;CO2+H2O+NaClO=NaHCO3+HClO;
HClO+OH-;CO2+H2O+NaClO=NaHCO3+HClO;
II.(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2ONH3·H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,故答案为:NH4Cl;①;
(2)C中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,其溶质为NH4Cl、NH3.H2O;D中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,故答案为:NH4Cl和NH3H2O;NH4Cl和HCl;
(3)因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,溶液显酸性,而题目要求该溶液恰好呈中性,因此c(HCl)<c(NH3H2O),
而HCl为强电解质,完全电离,NH3.H2O为弱电解质,不完全电离,则混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)>c(OH-),故答案为:小于。

【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O![]() H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_____pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=_______(保留三位有效数字)。
③0.lmol/LNa2N2O2溶液中离子浓度由大到小的顺序为____________。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1=-159.5kJmol-1;
NH2CO2NH4(s) △H1=-159.5kJmol-1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJmol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为____________。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为___________。
②图2中能正确反应平衡常数K随温度变化关系的曲线为__________(填字母标号)。

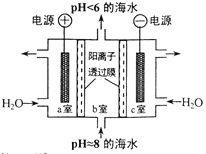
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为______________。
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 6.5 | 1.5 | 7.2 | 8.2 |
沉淀完全的pH | 9.9 | 3.3 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③_____等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式_____________
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为______________
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为_____________
②再加入ZnO控制反应液的pH范围为_____________
(4)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):Ksp(CdCO3)=5.2×10-12, Ksp(CdS)=3.6×10-29,Ksp(Cd(OH)2)=2.0×10-16,根据上述信息:沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=________________