题目内容
【题目】测定室温下NH3H2O的浓度及电离平衡常数Kb
(1)从三颈瓶中用(填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500molL﹣1HCl滴定.用pH计采集数据、电脑绘制滴定曲线如下图. 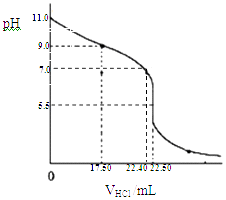
(2)据图,计算氨水的浓度为molL﹣1;写出NH3H2O电离平衡常数Kb的表达式,Kb= , 当pH=11.0时计算Kb的近似值,Kb≈ . (Kb保留两位有效数字)
(3)关于该滴定实验的说法中,正确的是 .
A.锥形瓶中有少量蒸馏水不影响测定结果
B.未滴加酸碱指示剂,实验结果不科学
C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D.滴定终点时俯视读数会导致测得氨水的浓度偏高.
【答案】
(1)碱式滴定管(或移液管)
(2)0.0450;  ;2.2×10﹣5
;2.2×10﹣5
(3)AC
【解析】解:(1)氨水中含有一水合氨,一水合氨电离出氢氧根离子而使溶液呈碱性,所以用移液管或碱式滴定管量取氨水,
所以答案是:碱式滴定管(或移液管);(2)氨水的物质的量浓度= ![]() mol/L=
mol/L= ![]() mol/L=0.0450mol/L;pH=11的氨水中c(OH﹣)=0.001mol/L,c(OH﹣)≈c(NH4+)=0.001mol/L,c(NH3H2O)≈0.0450mol/L,根据Kb=
mol/L=0.0450mol/L;pH=11的氨水中c(OH﹣)=0.001mol/L,c(OH﹣)≈c(NH4+)=0.001mol/L,c(NH3H2O)≈0.0450mol/L,根据Kb= ![]() =
= ![]() =2.2×10﹣5;
=2.2×10﹣5;
所以答案是:0.0450; ![]() ;2.2×10﹣5;(3)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量,所以不影响测定结果,故A正确;
;2.2×10﹣5;(3)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量,所以不影响测定结果,故A正确;
B.利用pH计判断滴定终点更准确,不需要酸碱指示剂即可,故B错误;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低,则使用盐酸的体积偏大,所以导致测定结果偏高,故C正确;
D.滴定终点时俯视读数会导致盐酸体积偏小,则盐酸物质的量偏小,测定结果偏低,故D错误.
所以答案是:AC.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.