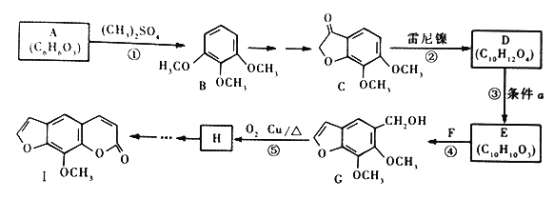
题目内容
【题目】某元素原子 M 层电子数比 K 层电子数多 5 个,该元素的最高正价为
A.+7B.+5C.+3D.无最高正价
【答案】A
【解析】
原子核外M电子层上有电子时,则K层、L层上电子数分别为2、8,则M电子层上的电子数为7,则该元素最外层电子全部失去时,该元素处于最高价,即最高正价为+7,故答案为:A。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】某小组研究溶液中Fe2+与NO2、NO3的反应。资料: [Fe(NO)]2+在溶液中呈棕色。
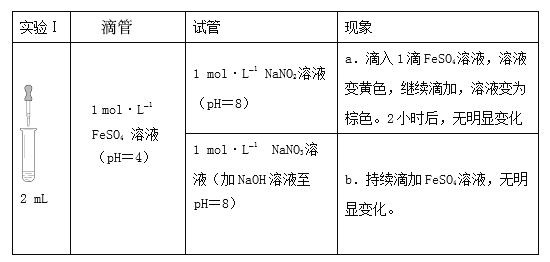
(1)研究现象a中的黄色溶液。
①用______溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是______。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。
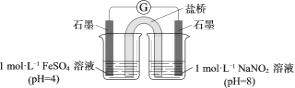
产生NO的电极反应式是______。
实验Ⅱ的目的是______。
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是______。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是______。
(3)研究酸性条件下,溶液中Fe2+与NO2、NO3的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L1的NaNO3溶液与1 mol·L1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是______、______。
②ⅲ中出现棕色的原因是______。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。