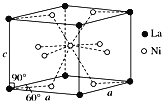
题目内容
【题目】(1)某有机物X由C、H、O三种元素组成,经测定其相对分子质量为90。取1.8gX在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g。则有机物X的分子式为___________。已知有机物X含有一个-COOH,在核磁共振氢谱上观察氢原子有四种特征峰,强度为3:1:1:l 。则X 的结构简式为_______________。
(2)和X具有相同官能团的芳香族化合物Y,分子式为C7H6O3 ,1molY分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗Na、NaOH、NaHCO3的物质的量之比为________。
(3)双酚A(也称BPA)常用来生产防碎塑料聚碳酸酯。BPA的结构简式如图所示。
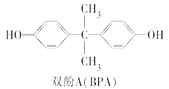
双酚A的一种合成路线如图所示:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A→B的化学方程式是_________________________________________。
(4)膳食纤维具有突出的保健功能,称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是(_____)
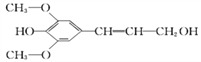
A.芥子醇的分子中有一种含氧官能团
B.芥子醇分子中所有碳原子不可能在同一平面上
C.芥子醇能与FeCl3溶液发生显色反应,且1mol芥子醇能够与3 mol的Br2水反应
D.芥子醇能发生的反应类型有氧化反应、取代反应、加成反应
【答案】 C3H6O3 ![]() 2:2:1 CH3CHBrCH3+NaOH→CH3CH(OH)CH3 + NaBr D
2:2:1 CH3CHBrCH3+NaOH→CH3CH(OH)CH3 + NaBr D
【解析】(1)由题意可知,某有机物X由C、H、O三种元素组成,相对分子质量为90,则1.8gX的物质的量为0.02mol,其在纯氧中完全燃烧的产物水和二氧化碳的质量分别为1.08g和2.64g,则1.8gX分子中n(H)= ![]() ,n(C)=
,n(C)= ![]() ,n(O)=
,n(O)= ![]() ,则有机物X的分子式为C3H6O3。已知有机物X含有一个—COOH,在核磁共振氢谱上观察氢原子有四种特征峰,强度为3:1:1:l 。则X 的结构简式为
,则有机物X的分子式为C3H6O3。已知有机物X含有一个—COOH,在核磁共振氢谱上观察氢原子有四种特征峰,强度为3:1:1:l 。则X 的结构简式为![]() 。
。
(2)和X具有相同官能团的芳香族化合物Y,分子式为C7H6O3 ,则Y为邻(或间、对)羟基苯甲酸,Y的分子中有酚羟基和羧基两种官能团,Na、NaOH都可以与这两种官能团反应,而NaHCO3溶液反应只能与羧基反应,所以,1molY分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1。
(3)由双酚A的结构简式可知,丙烯与溴化氢加成后生成2-溴丙烷,2-溴丙烷在碱性条件下发生水解反应生成异丙醇,异丙醇再发生催化氧化反应生成丙酮,最后丙酮与苯酚发生反应生成双酚A。所以,A→B的化学方程式是CH3CHBrCH3+NaOH→CH3CH(OH)CH3 + NaBr。
(4)由芥子醇的结构简式可知,芥子醇的分子中有酚羟基、醇羟基和醚键等多种含氧官能团;由于苯环中12原子共面、乙烯分子中6原子共面、单键可以旋转,所以,芥子醇分子中所有碳原子有可能在同一平面上;芥子醇有酚羟基,所以其能与FeCl3溶液发生显色反应;由于芥子醇苯环上羟基的邻位和对位都没有氢原子,所以1mol芥子醇只能够与1 mol Br2;根据芥子醇的官能团的性质可知,其能发生的反应类型有氧化反应、取代反应、加成反应。综上所述,有关芥子醇的说法正确的是D。

 53随堂测系列答案
53随堂测系列答案【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法
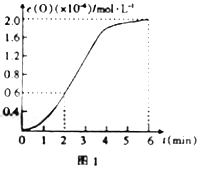
(1)用活性炭还原法可以处理氨氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ· mol-1。
N2(g)+CO2(g) △H=Q kJ· mol-1。
在T℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min 内,NO 的平均反应速率v(NO)=___________。
T1 ℃时,该反应的平衡常数K=___________。
②30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母)。___________。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min 后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3 ∶3,则Q________0(填“>”、“=”或“<”)。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。
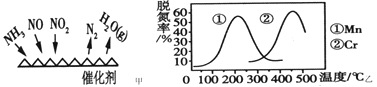
①由图甲可知,SCR技术中的氧化剂为___________。已知c(NO2)∶c(NO)=1∶1时脱氮效果最佳,若生成1mol N2时反应放出的热量为QkJ。此时对应的脱氮反应的热化学方程式为___________。
②图乙是不同催化剂Mn 和Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应的温度分别为________________。
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
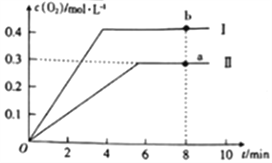
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g) ![]() N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
/p>
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。