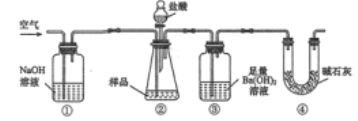
题目内容
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①已知:Cl元素在元素周期表中的位置可以描述为:第3行第17列,请用相同的形式描述Cr元素在元素周期表中的位置______________________。
②COCl2分子中所有原子均满足8电子构型,中心原子的杂化方式为________。COCl2分子中Cl—C—Cl之间的夹角______Cl—C—O之间的夹角(填“>”、“<”或“=”)。
(3)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
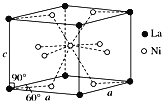
①该晶体的化学式为________________。
②已知该物质的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________nm3(用含M、d、NA的代数式表示)。
【答案】 7 第4行第6列 sp2 < LaNi5 M×1021 /(NAd)
【解析】 (1)Fe的基态原子的电子排布式为1s22s22p63s23p63d64s2,共有7种不同能级的电子。
(2)①元素周期表共有7行、18列。已知Cl元素在元素周期表中的位置可以描述为第3行第17列,同理,Cr元素在元素周期表中的位置第4行第6列。
②COCl2分子中所有原子均满足8电子构型,中心原子C原子的价层电子对数为3,故其杂化方式为sp2。由价层电子对互斥理论可知,COCl2分子中有碳氧双键,碳与氧之间形成2对共用电子,其对碳与氯之间形成的1对共用电子的排斥作用更大,所以,Cl—C—Cl之间的夹角<Cl—C—O之间的夹角。
(3)①由晶胞结构可知,La位于晶胞的8个顶点、有8个Ni位于面上,还有1个Ni位于晶胞的内部,故该晶胞中有1个La原子和5个Ni原子,该晶体的化学式为LaNi5。②已知该物质的摩尔质量为M g·mol-1,则NA个晶胞的质量为M g。由密度为d g·cm-3可以求出NA个晶胞的体积为![]() ,则该晶胞的体积是M×1021 /(NAd)nm3。
,则该晶胞的体积是M×1021 /(NAd)nm3。