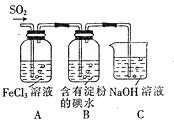
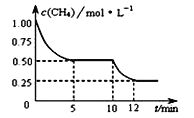
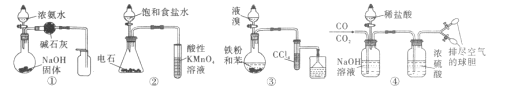
题目内容
【题目】方铅矿(主要成分是PbS,含少量ZnS、Fe、SiO2)是提炼铅及其化合物的重要矿物,其工艺流程如下所示:
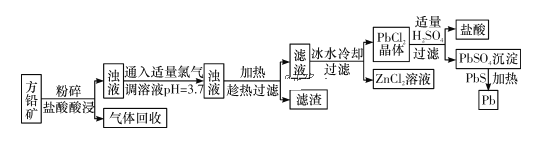
请回答下列问题:
(1)流程中“趁热”过滤的原因是_____,滤渣的主要成分是____。
(2)该工艺流程中可循环利用的物质是_____。
(3)PbSO4与PbS在加热条件下发生反应的化学方程式为_____。
(4)将PbO高温焙烧可制得铅丹(Pb3O4),铅丹中含有杂质PbO。PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,提纯时发生反应的离子方程式为____。
(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,电解过程中阳极的电极反应式为___;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9 g时(忽略副反应),理论上蓄电池负极增重____g。
【答案】防止PbCl2结晶析出 SiO2和Fe(OH)3 盐酸 PbS+PbSO4===2Pb+2SO2↑ PbO+2OH-===PbO22—+H2O Pb2++2H2O-2e-===PbO2+4H+ 9.6
【解析】
方铅矿(主要成分是PbS,含少量ZnS、Fe、SiO2),粉碎加盐酸,其中PbS、ZnS与盐酸反应生成氯化铅、氯化锌和硫化氢气体,铁与盐酸反应生成氯化亚铁和氢气,SiO2不反应,将氢气和硫化氢气体回收,向浊液中通入足量的氯气氧化亚铁离子,并调节溶液的pH,沉淀铁离子,为防止PbCl2结晶析出,趁热过滤,将SiO2和Fe(OH)3与氯化铅和氯化锌分离,则滤渣为SiO2和Fe(OH)3,冰水冷却滤液,PbCl2结晶析出,过滤,得到PbCl2晶体,向晶体加入适量的硫酸,生成硫酸铅沉淀,过滤,将硫酸铅沉淀与硫化铅加热反应制得铅。
(1)由分析可知,为防止PbCl2结晶析出,需趁热过滤;滤渣为SiO2和Fe(OH)3;
(2)流程中,反应消耗盐酸,向PbCl2晶体加入适量的硫酸又生成盐酸,可循环利用;
(3)PbSO4与PbS在加热条件下发生氧化还原反应,生成Pb和二氧化硫,化学方程式为:PbS+PbSO4===2Pb+2SO2↑;
(4)PbO与Al2O3性质相似,与氢氧化钠反应生成PbO22—和水,离子方程式为:PbO+2OH-==PbO22—+H2O;
(5)电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-==PbO2+4H+;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时,说明阳极生成PbO2的质量为23.9g,则n(PbO2)=![]() =0.1mol,转移电子为0.2mol,蓄电池的负极为Pb2e+SO42=PbSO4,转移电子数为0.2mol,则负极增重为0.1mol×303g/mol0.1×207g/mol=9.6g。
=0.1mol,转移电子为0.2mol,蓄电池的负极为Pb2e+SO42=PbSO4,转移电子数为0.2mol,则负极增重为0.1mol×303g/mol0.1×207g/mol=9.6g。

 53随堂测系列答案
53随堂测系列答案【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与 NaOH 完全反应,消耗 NaOH 物质的量:③>④
B.分别加水稀释 10 倍,四种溶液的 pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中 c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
D.在③溶液中:c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-)