题目内容
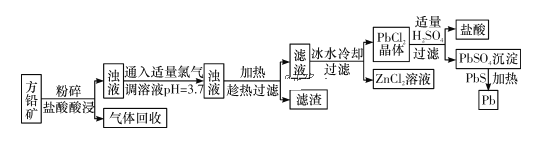
【题目】向盛有100mLHNO3溶液的烧杯中加入一定量的Cu、Al合金(还原产物为NO ),充分反应后向溶液中加入lmol/L的NaOH溶液,产生沉淀的质量与所加溶液的体积的关系如下图所示。则原HNO3溶液的物质的最浓度是

A. 0.4mol/L B. 0.45mol/L C. 0.525mol/L D. 0.625mol/L
【答案】C
【解析】沉淀达到最大值时所得溶液是硝酸钠,此时加入氢氧化钠的物质的量是0.04mol,根据原子守恒可知硝酸钠是0.04mol,因此没有被还原的硝酸是0.04mol;根据图像可知产生沉淀时消耗的氢氧化钠是0.0375mol,由于金属失去电子的物质的量与金属阳离子结合的氢氧根的物质的量相等,所以金属失去电子是0.0375mol,根据电子得失守恒可知被还原的硝酸是0.0375mol÷3=0.0125mol,所以原硝酸的物质的量是0.0525mol,浓度是0.0525mol÷0.1L=0.525mol/L,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目