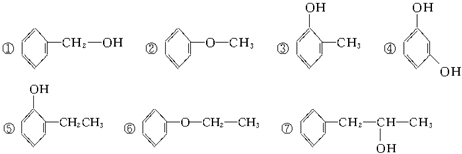
题目内容
2.类推的思维方式在化学学习与研究中经常采用,但类推得出的结论是否正确最终要经过实践的验证.以下类推的结论正确的是( )| A. | 由Cl2+H2O=HCl+HClO可推出F2+H2O=HF+HFO | |
| B. | HCl的水溶液是强酸,推出HF水溶液也是强酸 | |
| C. | 由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3 | |
| D. | Na、K在属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
分析 A、F2与H2O反应反应生成HF和氧气;
B、HF在水溶液中部分电离,是弱酸;
C、碘单质是弱氧化剂,所以Fe与I2反应只能生成FeI2;
D、根据K的性质比Na活泼来解答.
解答 解:A、因F2与H2O反应反应生成HF和氧气:2F2+2H2O═4HF+O2,故A错误;
B、因HF的水溶液是弱酸,而不是强酸,故B错误;
C、碘单质是弱氧化剂,所以Fe与I2反应生成FeI2:Fe+I2═FeI2,故C错误;
D、因同一主族从上到下,元素的金属性逐渐增强,故K常温下与水反应比Na常温下与水反应更剧烈,故D正确;
故选D.
点评 举出相反的事例,对于判断类推类判断中的错误判断,可以说是一种简便可行的有效方法.

练习册系列答案
相关题目
13.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,Y能分别与X、Z形成原子个数比为1:3的化合物,常温下YX3是一种刺激性气味的气体.下列说法正确的是( )
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | W的氯化物水溶液中滴加过量NaZ饱和溶液,可生成W的配合物用于冶金工业 | |
| C. | 由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | 已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
10.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A. | A | B. | B | C. | C | D. | D |
17.下列离子方程式中,不正确的是( )
| A. | 向FeCl2溶液中通入,2Fe2++Cl2=2Fe3++2Cl- | |
| B. | FeCl3溶液跟过量氨水,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸,Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ | |
| D. | 钠与水的反应,2Na+2H2O=2Na++2OH-+H2↑ |
7.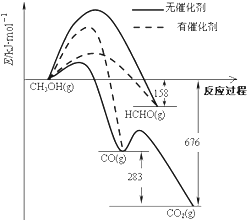 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
14.有机物命名正确的是( )
| A. |  1,3,4-三甲苯 | B. |  2-甲基-1-丙醇 | C. |  2-甲基-2-氯丙烷 | D. | 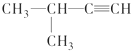 2-甲基-3-丁炔 |
11.下列物质在指定条件下电离方程式正确的是( )
| A. | Na2CO3溶于水 Na2CO3═Na22++CO32- | |
| B. | Al(OH)3酸式电离 Al(OH)3═H++AlO2-+H2O | |
| C. | NaHS溶于水HS-的电离 HS-+H2O?H2S+OH- | |
| D. | NaHCO3在水溶液中电离 NaHCO3═Na++HCO3- |
12.某甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸、和水等,某同学为了检验产品中的苯甲酸和硫酸,做了如下实验.(已知H2SO3:K1=1.3×10-2 K2=6.3×10-8,苯甲酸:Ka=6.46×10-5,碳酸;K1=4.30×10-7 K2=5.61×10-11)限选试剂:0.1 mol•L-1BaCl2溶液,0.1 mol•L-1Ba(OH)2溶液,1.0 mol•L-1Na2CO3溶液,1.0mol•L-1NaHCO3溶液,1 mol•L-1HCl溶液,1 mol•L-1Na2SO3溶液,1 mol•L-1NaHSO3溶液.
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |