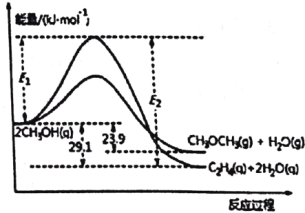
题目内容
【题目】分别取质量为a g的Fe2O3和CuO的混合固体粉末,进行如下实验:
(1)固体粉末在加热条件下用足量的CO还原,得到金属混合物b g,将生成的CO2气体用足量的澄清石灰水吸收后,产生c g白色沉淀。则a = ________g(用含b、c的代数式表示)。
(2)固体粉末溶于足量盐酸后,加入适量的铁粉,所得溶液中的金属离子只有Fe2+,同时收集到224 mL H2(标准状况下),共用去0.03 mol铁粉。则原混合物中Fe2O3的物质的量是________(用含a的代数式表示)。
【答案】b + 4c/25 (a/80 – 0.02) mol
【解析】
(1)设Fe2O3的物质的量为x mol,CuO为y mol,根据混合物的质量及其主要的化学方程式3CO+Fe2O3![]() 2Fe+3CO2和CO+CuO
2Fe+3CO2和CO+CuO![]() Cu+CO2可知,足量的CO还原,得到金属混合物为Fe和Cu,为b g,将生成的CO2气体用足量的澄清石灰水吸收后,产生c g白色沉淀为碳酸钙,则有n(CO2) = n(CaCO3),列方程组进行解答;
Cu+CO2可知,足量的CO还原,得到金属混合物为Fe和Cu,为b g,将生成的CO2气体用足量的澄清石灰水吸收后,产生c g白色沉淀为碳酸钙,则有n(CO2) = n(CaCO3),列方程组进行解答;
(2)固体粉末溶于足量盐酸后,加入适量的铁粉,所得溶液中的金属离子只有Fe2+,且有氢气冒出,则说明溶液中的Fe3+、Cu2+和H+依次与铁粉参与氧化还原反应,设参与反应的Fe2O3的物质的量为m mol,CuO的物质的量为n mol,根据化学方程式的等量关系及Fe2O3和CuO的混合固体粉末的质量,列方程组进行计算。
(1)设Fe2O3的物质的量为x mol,CuO为y mol,则有160g/mol×x mol + 80 g/mol×y mol = a g ①,根据化学方程式3CO+Fe2O3![]() 2Fe+3CO2和CO+CuO
2Fe+3CO2和CO+CuO![]() Cu+CO2,可知则得到的金属混合物中Fe为2x mol,Cu为y mol,则有56 g/mol×2x mol + 64 g/mol×y mol = b g ②,白色沉淀为碳酸钙,则n(CO2) = n(CaCO3) =
Cu+CO2,可知则得到的金属混合物中Fe为2x mol,Cu为y mol,则有56 g/mol×2x mol + 64 g/mol×y mol = b g ②,白色沉淀为碳酸钙,则n(CO2) = n(CaCO3) = ![]() = c/100 mol,增加的O原子来源于金属氧化物,则金属氧化物中O原子的物质的量为c/100 mol,即3x + y = c/100 mol ③,联立①②③,可得a = (b + 4c/25)g,
= c/100 mol,增加的O原子来源于金属氧化物,则金属氧化物中O原子的物质的量为c/100 mol,即3x + y = c/100 mol ③,联立①②③,可得a = (b + 4c/25)g,
故答案为:b + 4c/25;
(2)设固体粉末中Fe2O3的物质的量为m mol,CuO的物质的量为n mol,则160g/mol×m mol + 80 g/mol×n mol = a g ①,固体粉末溶于足量盐酸后,得到Fe3+和Cu2+,当加入适量的铁粉,所得溶液中的金属离子只有Fe2+,同时收集到224 mL H2(标准状况下),则发生的反应分别为:
Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+ = 3Fe2+,
![]() ,
,
同理,CuO+2H+=Cu2++H2O,Fe + Cu2+ = Cu+Fe2+,
![]() ,
,
Fe+2H+=Fe2++H2↑,
![]() ,共用去0.03 mol铁粉,则m mol + n mol + 0.01 mol = 0.03 mol②,联立方程①和②,则m = (a/80 – 0.02) mol,
,共用去0.03 mol铁粉,则m mol + n mol + 0.01 mol = 0.03 mol②,联立方程①和②,则m = (a/80 – 0.02) mol,
故答案为:(a/80 – 0.02) mol。

【题目】物质A可发生如图所表示的反应:
写出相应物质的化学式和类别(填在表格内),并依次写出各步反应的化学方程式。
A | B | C | D | E | |
化学式 | Cu | CuCl2 | ____ | ____ | ____ |
类 别 | _____ | _____ | 碱 | 氧化物 | 盐 |

(1)______________________________。
(2)______________________________。
(3)______________________________。
(4)______________________________。
(5)______________________________。
(6)______________________________ 。
(7)______________________________
【题目】制备纯净的液态无水四氯化锡的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
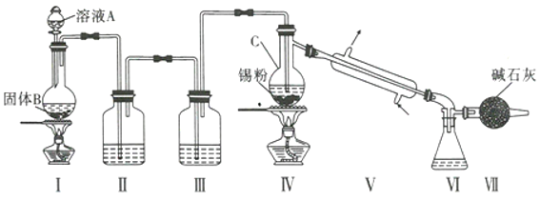
回答下列问题:
(1) Sn在元素周期表中的位罝为____________________________。
(2) Ⅱ、Ⅲ中的试剂分別为_______、__________;Ⅶ的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是_________________。
(6)写出SnCl4水解的化学方程式:________________________________________。