题目内容
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOC12=4LCl+S+SO2。
(1)组装该电池必须在无水、无氧的条件下进行,原因是______________________。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为___________。
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
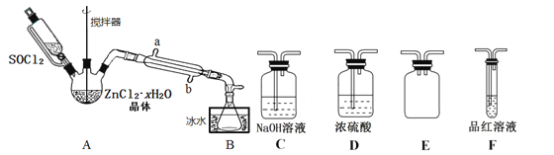
①用原理解释SOCl2在该实验中的作用:_________________________________。
②装置的连接顺序为A→B→______________________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl2的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为_________________________________。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加人足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
【答案】锂是活泼金属,易与![]() 反应;SOCl2也可与水反应 SOCl2+ H2O=SO2↑+2HCl↑ 2︰3︰1 SOCl2作脱水剂,与水反应生成HCl可以抑制氯化锌的水解 D→E→F→C daefcb
反应;SOCl2也可与水反应 SOCl2+ H2O=SO2↑+2HCl↑ 2︰3︰1 SOCl2作脱水剂,与水反应生成HCl可以抑制氯化锌的水解 D→E→F→C daefcb ![]() =
=![]() BaCl2溶液 K3[Fe(CN)6]溶液 若无蓝色沉淀出现
BaCl2溶液 K3[Fe(CN)6]溶液 若无蓝色沉淀出现
【解析】
(1) 锂易与H2O、O2反应,SOCl2也可与水反应;
(2)SOCl2与水反应生成SO2和HCl;
(3)①实验中SOCl2与ZnCl2·xH2O中的结晶水作用,生成无水ZnCl2及SO2和HCl气体;
②A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中二氧化硫与HCl,防止污染环境,E装置防止倒吸;
③检测ZnCl2xH2O晶体是否完全脱水,具体操作步骤为称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg;
(4)①SOCl2中+4价硫元素,FeCl3中铁元素具有氧化性,脱水过程中Fe3+会被还原为Fe2+,而SOCl2会被氧化为H2SO4;
②若滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应生成硫酸根;若滴加K3[Fe(CN)6]溶液,若没有生成蓝色沉淀则证明脱水过程铁离子没有发生还原反应生成亚铁离子。
(1)锂性质活泼,易与H2O、O2反应,SOCl2也可与水反应,组装该电池必须在无水、无氧的条件下进行,故答案为:锂是活泼金属,易与H2O、O2反应,SOCl2也可与水反应;
(2)SOCl2与水反应生成SO2和HCl,反应的方程式为SOCl2+H2O=SO2↑+2HCl↑;由硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜的原子利用率达100%可知,该反应为化合反应,反应的化学方程式为2S+3Cl2+SO3=3SOCl2,则三者的物质的量之比为2︰3︰1,故答案为:SOCl2+H2O=SO2↑+2HCl↑;2︰3︰1;
(3)①实验中SOCl2与ZnCl2·xH2O中的结晶水作用,生成无水ZnCl2及SO2和HCl气体,SOCl2吸水,生成的HCl抑制ZnCl2水解,故答案为:SOCl2作脱水剂,与水反应生成HCl可以抑制氯化锌的水解;
②A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→E→F→C,故答案为:D→E→F→C;
③检测ZnCl2xH2O晶体是否完全脱水,可以测定一定质量的样品与足量的硝酸银反应生成氯化银沉淀的质量,从而确定是否为纯净的氯化锌,具体操作步骤为:称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg,故答案为:daefcb;
(4)①SOCl2中+4价硫元素,FeCl3中铁元素具有氧化性,脱水过程中Fe3+会被还原为Fe2+,而SOCl2会被氧化为H2SO4,反应的离子方程式为:SOCl2+2Fe3++3H2O=SO42—+6H++2Fe3++2Cl—,故答案为:SOCl2+2Fe3++3H2O=SO42—+6H++2Fe3++2Cl—;
②方案一为检验加水溶解的溶液中是否含有硫酸根,检验硫酸根的试剂是氯化钡溶液,若滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应,故答案为:BaCl2溶液;
方案二为检验加水溶解的溶液中是否含有亚铁离子,检验亚铁离子时,因为氯离子检验干扰,不能选用酸性KMnO4溶液,应该选用K3[Fe(CN)6]溶液,若滴加K3[Fe(CN)6]溶液,若没有生成蓝色沉淀则证明脱水过程没有发生氧化还原反应,故答案为:K3[Fe(CN)6]溶液;若无蓝色沉淀出现。

【题目】下列说法正确的是
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.因为水分子间存在氢键,所以水分子的稳定性很好
C.离子晶体一定含有金属阳离子
D.元素的非金属性越强,其单质的活泼性一定越强
【题目】在标准状况下进行甲、乙、丙三组实验,三组实验均各取相同物质的量的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见表:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体/mL | 280 | 336 | 336 |
请回答下列问题:
(1)要算出盐酸的物质的量,题中作为计算依据的数据是___,求得的盐酸的溶质物质的量为___;
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是___,求得请务必写出计算过 程:___。






