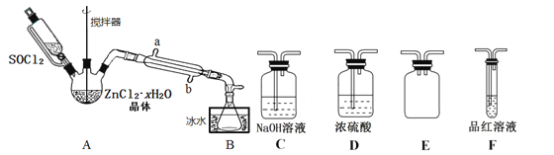
题目内容
【题目】KI用于分析试剂、感光材料制药和食品添加剂等。
制备原理如下:反应① 3I2+6 KOH =a KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O

按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为______________________,用该装置还可以制备___________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到______________________(填现象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液,并对KI混合液水浴加热,其目的是______________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________,其中加入碳酸钡的作用是______________________。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________g。
【答案】ZnS + H2SO4 ═ H2S↑+ Zn SO4 H2 (CO2) 棕黄色溶液变为无色 打开启普发生器活塞,通入气体 使溶液酸化并加热,有利于H2S溢出,从而除去H2S 硫 除去多余的硫酸 33.2g
【解析】
(1)启普发生器中发生的的反应用于制备H2S,属于固体与液体不加热的反应制气装置,用该装置还可以制备H2 (CO2) 等。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,发生① 3I2+6 KOH =a KIO3+5KI+3H2O,待观察到棕黄色溶液变为无色,停止滴人KOH溶液;然后通入H2S,完成反应② 3H2S+KIO3=3S↓+KI+3H2O,打开启普发生器活塞,通入气体,待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液使溶液酸化,并对KI混合液水浴加热,有利于H2S溢出,从而除去H2S。
(4)沉淀中有反应②生成的硫,过量的硫酸用碳酸钡除去。
(5)如果得到3.2g硫单质,则理论上制得的KI,根据方程式得关系式3S~6KI计算。
(1)启普发生器中发生的的反应用于制备H2S, 化学方程式为:ZnS + H2SO4 ═ H2S↑+ Zn SO4 ,属于固体与液体不加热的反应制气装置,用该装置还可以制备H2 (CO2) 等。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,发生① 3I2+6 KOH =a KIO3+5KI+3H2O,待观察到棕黄色溶液变为无色,停止滴人KOH溶液;然后通入H2S,完成反应② 3H2S+KIO3=3S↓+KI+3H2O,打开启普发生器活塞,通入气体,待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液使溶液酸化,并对KI混合液水浴加热,目的:使溶液酸化并加热,有利于H2S溢出,从而除去H2S。
(4)沉淀中有反应②生成的硫,过量的硫酸用碳酸钡除去。
把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和硫,其中加入碳酸钡的作用是除去多余的硫酸 。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为:
反应① 3I2+6 KOH =1KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O得关系式
S~2KI
32 2×166
3.2g m
m= 33.2g

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】(1)了解用药常识,有利于自我保健。现有下列药物:
A.阿司匹林(乙酰水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是____________。(填字母)
②治疗胃酸过多,但患有严重的胃溃疡,应该选择___________。(填字母)
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是____________。(填字母)
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是___________。(填字母)
(2)防治环境污染,改善生态环境已成为全球的共识。
①今年入冬以来,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是_______(填字母)。
A.SO2 B.NO2 C.PM2.5
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________ (填字母)标志的垃圾筒内。

③工业废水需处理达标后才能排放。下列废水处理的方法合理的是____________。
A.用中和法除去废水中的酸
B.用混凝剂除去废水中的重金属离子
C.用氯气除去废水中的悬浮物
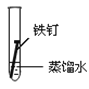
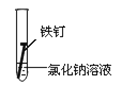
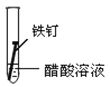
(3)全世界每年因钢铁锈蚀造成大量的损失。某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验。
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为______的试管中铁钉锈蚀速度最慢。
②下列防止钢铁锈蚀的措施不合理的是__________(填字母)。
A.在自行车的钢圈表面镀镍
B.在地下钢铁管道上连接铜块
C.改变金属内部结构制成不锈钢
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:铁锅的腐蚀主要是由__________________腐蚀造成的。