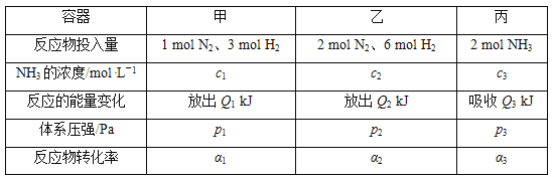
题目内容
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成 A、B 两室,向 A 中充入一定量 H2、O2 的混合气体,向 B 中充入 1 mol 空气,此时活塞的位置如图所示。

(1)A 室混合气体的物质的量为______,所含分子总数约______。
(2)实验测得 A 室混合气体的质量为 34 g,则该混合气体的密度是同温同压条件下氦气密度的______倍。
(3)若将 A 室 H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在______刻度,容器内气体压强与反应前气体压强之比为______。
【答案】2mol 1.204×1024 4.25 2 1:2
【解析】
(1)同温同压下,气体的物质的量之比等于其气体之比;根据N=nNA计算分子数目;
(2)计算A室中混合气体的平均摩尔质量,同温同压下气体的密度之比等于其摩尔质量之比;
(3)根据总质量、总物质的量列方程计算氢气与氧气物质的量,根据方程式计算反应后剩余气体物质的量,恢复原温度后最终两室中压强相等,体积之比等于其物质的量之比,可以确定活塞停留的位置;B室中空气物质的量不变、温度不变,反应前后压强之比与反应前后体积成反比。
(1)相同条件下,气体的体积之比等于其物质的量之比,1mol空气占容器总体积的1/3,空气和H2、O2 的混合气体的体积之比为1:2,则其物质的量之比为1:2,所以混合气体的物质的量为2mol,所含分子总数约为2×6.02×1023=1.204×1024,故答案为:2mol;1.204×1024;
(2)设H2的物质的量为x,O2的物质的量为y,则有关系式:x+y=2,2x+32y=34,解联立方程得,x= 1mol、y=1mol,该混合气体的平均相对分子质量=2×1/2+32×1/2=17,由同温同压条件下密度之比等于摩尔质量之比可知,则该混合气体的密度是同温同压条件下氦气密度的17/4=4.25倍, 故答案为:4.25;
(3) 若将 A 室 H2、O2的混合气体点燃引爆,由方程式可知氧气有谁剩余,剩余氧气为1mol-1mol×1/2=0.5mol,恢复原温度后最终两室中压强相等,体积之比等于其物质的量之比,则A、B两室的体积之比为0.5mol:1mol=1:2,则活塞停留在2刻度处;A室中空气物质的量不变、温度不变,反应前后压强之比与反应前后体积成反比,则容器内气体压强与反应前气体压强之比为2:4=1:2,故答案为:2;1:2。