题目内容
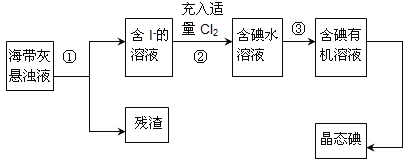
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下:

请回答下列问题:
(1)Sn(ⅣA)、As(VA)、Sb(VA)三种元素中,As和Sb最高正化合价为___________,Sn的原子序数为50,其原子结构示意图为___________。
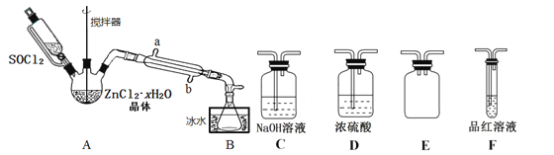
(2)从溶液中得到锡酸钠晶体的实验操作是___________、趁热过滤、干燥。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3,其作用是______________________;如图是“碱浸”实验的参数,请选择“碱浸”的合适条件_________________________________。

(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时发生的化学方程式为______________________。
【答案】+5 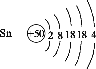 蒸发结晶 把SnO氧化成SnO32- 100g·L-1烧碱浓度、温度85℃ PbO22- + S2- + 2H2O═PbS↓+ 4OH- 5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH
蒸发结晶 把SnO氧化成SnO32- 100g·L-1烧碱浓度、温度85℃ PbO22- + S2- + 2H2O═PbS↓+ 4OH- 5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH
【解析】
(1)As和Sb同主族,最高正化合价相同,Sn与碳同主族,Sn的原子序数为50,最外层电子数为4,写出原子结构示意图。
(2)从溶液中得到锡酸钠晶体用结晶法,实验操作是蒸发结晶、趁热过滤、干燥。
(3)NaNO3具有氧化性,能将SnO氧化;根据图示分析最佳条件。
(4)Na2PbO2的溶液与硫化钠反应形成硫化铅,由电荷守恒写出离子方程式。
(5)由图“脱锑”时加入锡将锑还原。
(1)As和Sb同主族,最高正化合价相同,最高正价为+5价,Sn与碳同主族,Sn的原子序数为50,最外层电子数为4,写出原子结构示意图: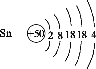 。
。
(2)从溶液中得到锡酸钠晶体用结晶法,实验操作是蒸发结晶、趁热过滤、干燥。
(3)NaNO3具有氧化性,能将SnO氧化,“碱浸”时,若SnO含量较高,工业上则加入NaNO3,其作用是把SnO氧化成SnO32- ;
由第一幅图得出最佳烧碱浓度100g·L-1,由第二幅图最佳温度85℃ 。
(4)Na2PbO2的溶液与硫化钠反应形成硫化铅,由电荷守恒写出离子方程式: PbO22- + S2- + 2H2O═PbS↓+ 4OH- 。
(5)由图“脱锑”时加入锡将锑还原:5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案