题目内容
【题目】(1)用双线桥法表示出下列反应的电子转移方向和数目。
①3S+6KOH![]() K2SO3+2K2S+3H2O__________________________
K2SO3+2K2S+3H2O__________________________
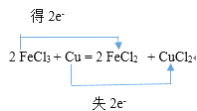
②2FeCl3+Cu=2FeCl2+CuCl2________________________________
(2)现用如图所示的装置制取饱和氯水,请回答有关问题:
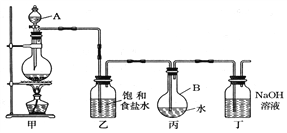
①写出装置甲中发生反应的化学方程式:_________________________。
②装置乙的作用是:______________________。
③若丁装置中为NaOH与酚酞的混合溶液,将氯气通入丁装置中,溶液红色褪去,则推测可能的原因是:
a.________________________________________;
b.________________________________________。
【答案】 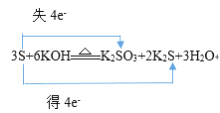
 4HCl(浓) + MnO2
4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑+ 2H2O 除去氯气中混有的氯化氢气体杂质 氯气与NaOH反应,将NaOH反应了,溶液褪色 HClO的漂白性,使溶液褪色
MnCl2 + Cl2↑+ 2H2O 除去氯气中混有的氯化氢气体杂质 氯气与NaOH反应,将NaOH反应了,溶液褪色 HClO的漂白性,使溶液褪色
【解析】试题分析:(1) ①3S+6KOH![]() K2SO3+2K2S+3H2O的反应中,硫原子化合价由0变为+4,硫原子化合价由0变为-2,化合价升降的最小公倍数是4,所以转移电子数是4;②2FeCl3+Cu=2FeCl2+CuCl2的反应中,铜元素失去2个电子,铁元素得到2个电子;
K2SO3+2K2S+3H2O的反应中,硫原子化合价由0变为+4,硫原子化合价由0变为-2,化合价升降的最小公倍数是4,所以转移电子数是4;②2FeCl3+Cu=2FeCl2+CuCl2的反应中,铜元素失去2个电子,铁元素得到2个电子;
(2)①甲中二氧化锰与浓盐酸反应生成氯气、氯化锰、水;
②甲中生成的氯气含有杂质氯化氢。
③NaOH与酚酞的混合溶液呈红色,将氯气通入丁装置中,氯气消耗氢氧化钠,氯气与水反应的产物次氯酸具有漂白作用。
解析:(1) ①3S+6KOH![]() K2SO3+2K2S+3H2O的反应中,硫原子化合价由0变为+4,硫原子化合价由0变为-2,化合价升降的最小公倍数是4,所以转移电子数是4,用双线桥表示出反应的电子转移方向和数目是
K2SO3+2K2S+3H2O的反应中,硫原子化合价由0变为+4,硫原子化合价由0变为-2,化合价升降的最小公倍数是4,所以转移电子数是4,用双线桥表示出反应的电子转移方向和数目是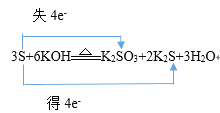 ;②2FeCl3+Cu=2FeCl2+CuCl2的反应中,铜元素失去2个电子,铁元素得到2个电子,用双线桥表示出反应的电子转移方向和数目是
;②2FeCl3+Cu=2FeCl2+CuCl2的反应中,铜元素失去2个电子,铁元素得到2个电子,用双线桥表示出反应的电子转移方向和数目是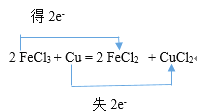 ;
;
(2)①甲中二氧化锰与浓盐酸反应生成氯气、氯化锰、水,反应方程式是4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑+ 2H2O;
MnCl2 + Cl2↑+ 2H2O;
②甲中生成的氯气含有杂质氯化氢,饱和食盐水的作用是除去氯气中的氯化氢。
③NaOH与酚酞的混合溶液呈红色,将氯气通入丁装置中,氯气消耗氢氧化钠,氯气与水反应的产物次氯酸具有漂白作用。所以溶液红色褪去的可能原因是a.氯气与NaOH反应,将NaOH反应了,溶液褪色;b. HClO的漂白性,使溶液褪色。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案