题目内容
【题目】用KMnO4氧化密度为1.19g/mL、质量分数为36.5%的盐酸。反应的化学方程式如下:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题:
(1)求该盐酸的物质的量浓度。
(2)耗15.8 g KMnO4时,有多少摩尔HCl被氧化?
(3)耗15.8 g KMnO4时,产生的Cl2在标准状况下的体积为多少?
【答案】(1)11.9 mol/L;(2)0.5 mol;(3)5.6 L
【解析】试题分析:根据![]() 计算物质的量浓度;根据化学方程式计算耗15.8 g KMnO4时,参加反应的HCl的物质的量、生成氯气的物质的量,被氧化的HCl占总参加反应的HCl的
计算物质的量浓度;根据化学方程式计算耗15.8 g KMnO4时,参加反应的HCl的物质的量、生成氯气的物质的量,被氧化的HCl占总参加反应的HCl的![]() 。
。
解析:(1)![]() =
= ![]() ;
;
设消耗15.8 g KMnO4时,参加反应的HCl的物质的量是x mol;生成氯气的物质的量是y mol;
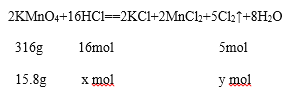
![]() 、
、![]() ,解得x=0.8 mol;y=0.25 mol;
,解得x=0.8 mol;y=0.25 mol;
(2)被氧化的HCl占总参加反应的HCl的![]() ,消耗15.8 g KMnO4时,被氧化的HCl的物质的量是0.8 mol×
,消耗15.8 g KMnO4时,被氧化的HCl的物质的量是0.8 mol×![]() =0.5mol。
=0.5mol。
(3)消耗15.8 g KMnO4时,产生的Cl2在标准状况下的体积为0.25 mol×22.4L/mol=5.6L

练习册系列答案
相关题目
【题目】下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A-E中选择各题要求的序号填入表中

A B C D E
溶液 | 加入的物质 | 答案序号 |
饱和石灰水 | 通CO2至过量 | _____ |
AlCl3溶液 | 通过量的NH3 | _____ |
含少量NaOH的NaAlO2溶液 | 通过量的CO2 | _____ |
NaAlO2溶液 | 滴加稀HCl至过量 | _____ |
MgCl2 AlCl3的混和液 | 滴加NaOH至过量 | _____ |