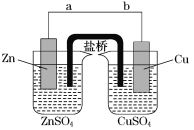
题目内容
【题目】已知:2H2(g)+O2(g)![]() 2H2O(l) ΔH=571.6 kJ·mol1,CO(g)+
2H2O(l) ΔH=571.6 kJ·mol1,CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=282.8 kJ·mol1,现有CO、H2和CO2组成的混合气体112.0 L(标准状况),经完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
CO2(g) ΔH=282.8 kJ·mol1,现有CO、H2和CO2组成的混合气体112.0 L(标准状况),经完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
A.80% B.40% C.60% D.20%
【答案】B
【解析】由题意H2(g)~H2O(l),则反应前V(H2)=![]() ×22.4 L·mol1=22.4 L,H2燃烧放出的热量Q=571.6×
×22.4 L·mol1=22.4 L,H2燃烧放出的热量Q=571.6×![]() kJ=285.8 kJ,则V(CO)=
kJ=285.8 kJ,则V(CO)=![]() ×22.4L·mol1=44.8 L,故CO的体积分数=
×22.4L·mol1=44.8 L,故CO的体积分数=![]() ×100%=40%。
×100%=40%。

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目