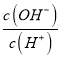题目内容
【题目】有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4molL﹣1 , SO42﹣的物质的量浓度为0.7molL﹣1 , 则此溶液中K+的物质的量浓度为( )
A.0.1 molL﹣1
B.0.15 molL﹣1
C.0.2 molL﹣1
D.0.25 molL﹣1
【答案】C
【解析】解:溶液中Al3+的物质的量浓度为0.4molL﹣1 , SO42﹣的物质的量浓度为0.7molL﹣1 , 根据溶液电荷守恒,溶液中c(K+)+3c(Al3+)=2c(SO42﹣),所以c(K+)+3×0.4molL﹣1=2×0.7molL﹣1 , 解得c(K+)=0.2molL﹣1 . 故选:C.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是___________________________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂 :______________________________
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有_______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由__________________________________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________________________。
②根据K2FeO4的制备实验得出:氧化性Cl2_______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。