题目内容
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是___________________________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂 :______________________________
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有_______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由__________________________________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________________________。
②根据K2FeO4的制备实验得出:氧化性Cl2_______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
【答案】2KMnO4+16HCl![]() 2MnCl2+2KCl +5Cl2↑+8H2O 或2MnO4-+16H++10Cl-
2MnCl2+2KCl +5Cl2↑+8H2O 或2MnO4-+16H++10Cl-![]() 2Mn2++5Cl2↑+8H2O
2Mn2++5Cl2↑+8H2O Cl2+2OH
Cl2+2OH![]() Cl+ClO+H2OFe3+4FeO42+20H+
Cl+ClO+H2OFe3+4FeO42+20H+![]() 4Fe3++3O2↑+10H2O洗去固体表面附着的ClO,排除ClO的干扰>溶液的酸碱性不同
4Fe3++3O2↑+10H2O洗去固体表面附着的ClO,排除ClO的干扰>溶液的酸碱性不同
【解析】
(1)①A为氯气发生装置,由高锰酸钾和浓盐酸反应制取得到Cl2,MnO4-被还原为Mn2+,Cl-被氧化为Cl2,写出反应的方程式;
②装置B为除杂装置,浓盐酸会挥发产生HCl,使得产生的Cl2中混有HCl,要除去HCl,可将混合气体通过饱和食盐水;
③C中得到紫色固体和溶液,紫色的溶液为K2FeO4,碱性条件下,Cl2可以氧化Fe(OH)3制取K2FeO4,还存在Cl2和KOH反应;
(2)①i.方案I中加入KSCN溶液至过量,溶液呈红色,说明反应产生Fe3+,不能判断一定K2FeO4将Cl-氧化,但K2FeO4在碱性溶液中稳定,酸性溶液中快速产生O2,自身转化为Fe3+;
ii.方案Ⅱ可证明K2FeO4氧化了Cl-,使用KOH溶液溶出K2FeO4晶体,使K2FeO4稳定析出,并除去ClO-离子,防止酸性条件下ClO-和Cl-反应产生Cl2干扰实验;
②Fe(OH)3在碱性条件下被Cl2氧化为FeO42-,可以说明Cl2的氧化性大于FeO42-,而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,方案Ⅱ是FeO42-在酸性条件下氧化Cl-生成Cl2,两种反应体系所处酸碱性介质不一样;
(1)①A为氯气发生装置,由高锰酸钾和浓盐酸反应制取得到Cl2,MnO4-被还原为Mn2+,Cl-被氧化为Cl2,所以反应的方程式为:2MnO4-+10Cl-+16H+═5Cl2↑+2Mn2++8H2O;
②装置B为除杂装置,反应使用浓盐酸,浓盐酸会挥发产生HCl,使得产生的Cl2中混有HCl,需要除去HCl,可将混合气体通过饱和食盐水达到除杂的目的,所以装置B应为: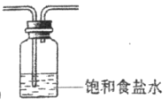
③C中得到紫色固体和溶液,紫色的为K2FeO4,在碱性条件下,Cl2可以氧化Fe(OH)3制取K2FeO4,还存在反应为Cl2和KOH反应,所以还发生的反应方程式为:Cl2+2KOH═KCl+KClO+H2O;
(2)①i.方案I中加入KSCN溶液至过量,溶液呈红色,说明反应产生Fe3+,但该离子的产生不能判断一定K2FeO4将Cl-氧化,注意K2FeO4在碱性溶液中稳定,酸性溶液中快速产生O2,自身转化为Fe3+,发生反应为:Fe3+;4FeO42-+20H+═4Fe3++3O2↑+10H2O;
ii.方案Ⅱ可证明K2FeO4氧化了Cl-,使用KOH溶液溶出K2FeO4晶体,可以使K2FeO4稳定析出,同时考虑到K2FeO4表面可能吸附ClO-,ClO-在酸性条件下可与Cl-反应生成Cl2,从而干扰实验,所以用KOH溶液洗涤的目的是:使K2FeO4稳定溶出,并把K2FeO4表面吸附的ClO-除尽,防止ClO-与Cl-在酸性条件下反应产生Cl2,避免ClO-干扰实验;
②Fe(OH)3在碱性条件下被Cl2氧化为FeO42-,可以说明Cl2的氧化性大于FeO42-,而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,方案Ⅱ是FeO42-在酸性条件下氧化Cl-生成Cl2,两种反应体系所处酸碱性介质不一样,溶液酸碱性会影响粒子氧化性的强弱;

【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是_________________。
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的离子方程式____________________。
(3)为保证产品的纯度,调节pH的范围为___________,调pH值可以选用(填字母)_______。
a.Cu(OH)2 b.H2SO4 c.NH3H2O d.Na2CO3 e.CuO
(4)煮沸硫酸铜溶液的原因是____________。
(5)CuCl产品中CuCI的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.80mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。则CuCl产品中CuCl的质量分数为_____。
(6)已知Fe(OH)3能与次氯酸钾碱性溶液发生反应生成具有强氧化性的高铁酸钾(K2FeO4),高铁酸钾可作为新型多功能水处理剂的原因是___________________。