题目内容
17.下列关于有机化合物的说法正确的是( )| A. | 聚氯乙烯分子中含碳碳双键 | B. | 以淀粉为原料可制取乙酸乙酯 | ||
| C. | 丁烷有3种同分异构体 | D. | 油脂的皂化反应属于加成反应 |
分析 A.根据聚氯乙烯(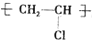 )的结构分析;
)的结构分析;
B.淀粉水解生成葡萄糖,葡萄糖发酵生成乙醇,乙醇氧化生成乙醛,乙醛氧化生成乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯;
C.丁烷有2种同分异构体;
D.有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,油脂的皂化反应属于油脂的水解反应.
解答 解:A.聚氯乙烯的结构简式为: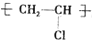 ,聚氯乙烯中不含碳碳双键,故A错误;
,聚氯乙烯中不含碳碳双键,故A错误;
B.淀粉水解生成葡萄糖(C6H10O5)n+nH2OnC6H12O6,乙醇氧化生成乙醛2CH3CH2OH+O22CH3CHO+2H2O,乙醛氧化生成乙酸2CH3CHO+O22CH3COOH,CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,以淀粉为原料可制取乙酸乙酯,故B正确;
CH3COOCH2CH3+H2O,以淀粉为原料可制取乙酸乙酯,故B正确;
C.丁烷分子式为C4H10,有2种同分异构体,正丁烷结构简式为CH3CH2CH2CH3,异丁烷结构简式为(CH3)2CHCH3,故C错误;
D.油脂的皂化反应为油脂在碱性条件下的水解反应,如: +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+ ,该反应属于取代反应,故D错误;
,该反应属于取代反应,故D错误;
故选B.
点评 本题考查了有机物的结构和性质,题目难度不大,注意聚乙烯中不含碳碳双键,为易错点,D选项注意加成反应与水解反应的区别.

练习册系列答案
相关题目
7.具有一个醇羟基的有机物A7g与乙酸在一定条件下反应后生成10.2g乙酸某酯,经分析还有1gA剩余,则A的结构简式可能是( )
①CH3CH2OH ②CH3CH2CH2CH2OH ③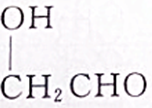 ④
④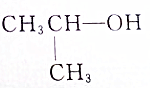
①CH3CH2OH ②CH3CH2CH2CH2OH ③
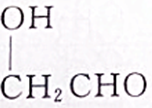 ④
④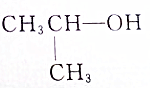
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
12.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
2.研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
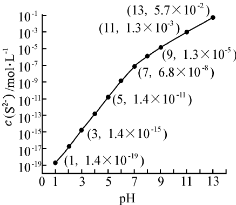
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
9.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程: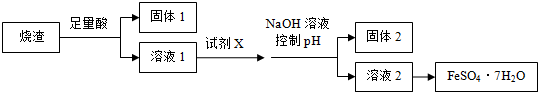
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
3.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2=CHCN | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
4. 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |







 +2NaBr.
+2NaBr.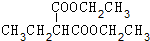 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.