题目内容
3. 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.(1)该微粒是中性微粒,这种微粒的元素符号是Ne.
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式2F2+2H2O═4HF+O2.
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑.
(4)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式H-O-H.
(5)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
分析 (1)该微粒是中性微粒,质子数10,为Ne原子;
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,则原子质子数为2+8-1=9,为F-离子,其单质氟气与水反应生成HF与氧气;
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,则原子质子数为2+8+1=11,为Na+离子,其单质Na与水反应生成氢氧化钠与氢气;
(4)该微粒的还原性很弱,失去2个电子后变成原子,则原子质子数为2+8-2=6,为O2-离子,其氢化物为H2O,分子中氧原子与氢原子之间形成1对共用电子对;
(5)该微粒的符号为X3+,原子质子数为2+8+3=13,则为Al3+,氢氧化铝与强碱反应生成偏铝酸盐与水.
解答 解:(1)该微粒是中性微粒,则为Ne原子,故答案为:Ne;
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,则原子质子数为2+8-1=9,为F-离子,其单质氟气与水反应生成HF与氧气,反应方程式为:2F2+2H2O=4HF+O2,故答案为:2F2+2H2O═4HF+O2;
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,则原子质子数为2+8+1=11,为Na+离子,其单质Na与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(4)该微粒的还原性很弱,失去2个电子后变成原子,则原子质子数为2+8-2=6,为O2-离子,其氢化物为H2O,分子中氧原子与氢原子之间形成1对共用电子对,其结构简式为H-O-H,故答案为:H-O-H;
(5)该微粒的符号为X3+,原子质子数为2+8+3=13,则为Al3+,氢氧化铝与强碱反应生成偏铝酸盐与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查较为综合,为高频考点,涉及结构示意图、结构式、离子方程式等,要注意阴离子:质子数=核外电子数-电荷数,阳离子=核外电子数+电荷数,难度不大.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 液氨受热蒸发 | B. | 加热碘化氢气体使之分解 | ||
| C. | 加热氯化钠晶体使之熔化 | D. | HCl气体溶于水 |
| A. | 3-甲基丁烷 | B. | 1,1,3-三甲基戊烷 | ||
| C. | 2,2,4,4-四甲基辛烷 | D. | 4-丁烯 |
 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )| A. | a为负极,b为正极 | |
| B. | 该电池工作时PbO2电极附近溶液的pH增大 | |
| C. | a极的电极反应为Cu-2e-═Cu2+ | |
| D. | 调节电解质溶液的方法是补充CuSO4 |
| A. | 任何氧化还原反应原则上都可以设计成原电池 | |
| B. | 原电池中电子从负极经导线流入正极 | |
| C. | 原电池中正极得电子数与负极失电子数一定相等 | |
| D. | 铜-锌-稀硫酸组成的原电池,电解质溶液中H+向负极移动 |
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 1:4 |
 命名:2,2,3,4-四甲基戊烷.
命名:2,2,3,4-四甲基戊烷.






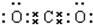
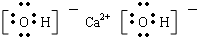


 .
.