题目内容
12.下列有关原电池的说法中不正确的是( )| A. | 任何氧化还原反应原则上都可以设计成原电池 | |
| B. | 原电池中电子从负极经导线流入正极 | |
| C. | 原电池中正极得电子数与负极失电子数一定相等 | |
| D. | 铜-锌-稀硫酸组成的原电池,电解质溶液中H+向负极移动 |
分析 A、原电池的反应必须是自发的氧化还原反应;
B、原电池中负极失电子,电子从负极经外电路流向正极;
C、原电池中符合电荷守恒;
D、原电池中阳离子移向正极.
解答 解:A、原电池的反应必须是自发的氧化还原反应,从理论上来讲,任何自发的氧化还原反应均可设计为原电池,故A正确;
B、原电池中电子总负极流向正极,故B正确;
C、原电池中负极得电子数与正极失电子数相同,符合电子守恒,故C正确;
D、原电池中阳离子移向正极,故D错误;
故选D.
点评 本题考查原电池基础知识,比较基础,注意对原电池正负极反应原理的理解掌握,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列说法正确的是( )
| A. | 化学反应都是吸热反应 | |
| B. | 化学反应都是放热反应 | |
| C. | 物质发生化学反应都伴随着能量变化 | |
| D. | 有能量变化的物质变化都是化学变化 |
4.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.

已知:各离子开始沉淀及完全沉淀时的pH如表所示.
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)物质A最好使用下列物质中的B.
A.KMnO4B.H2O2C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.

已知:各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)物质A最好使用下列物质中的B.
A.KMnO4B.H2O2C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
1.已知下列反应的焓变:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ•mol-1
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8KJ•mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为( )
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ•mol-1
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8KJ•mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为( )
| A. | -870.3KJ•mol-1 | B. | -571.6KJ•mol-1 | C. | +787.0KJ•mol-1 | D. | -488.3KJ•mol-1 |
2.下列说法正确的是( )
| A. | 在实验室中将工业酒精转化为无水酒精的方法是:加入过量的生石灰后分液 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 用重结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| D. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
 和
和 ⑤H2O和H2O2
⑤H2O和H2O2 .
. 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.


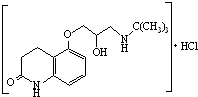 )可用于治疗心绞痛和青光眼.
)可用于治疗心绞痛和青光眼.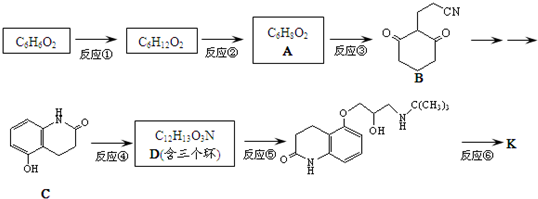
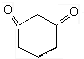 D
D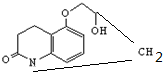
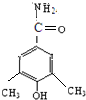
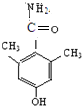 、
、
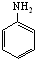 )与HNO2和H3PO2反应可得苯.请设计从C合成
)与HNO2和H3PO2反应可得苯.请设计从C合成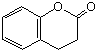 的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)