题目内容
15.写出下列物质的电子式:Na2O2

NH4Cl

CO2
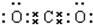
Ca(OH)2
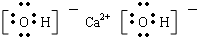
HCl

NH3

N2
 .
.
分析 过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成;
氢原子最外层1个电子,氯原子最外层7个电子,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物;
NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子;
氮气中存在3对共用电子对,氮原子最外层达到8个电子.
解答 解:Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: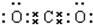 ;
;
Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为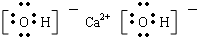 ;
;
HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ;
;
NH3的电子式为: ;
;
氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故答案为:
,故答案为: ;
; ;
;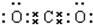 ;
;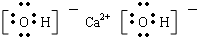 ;
; ;
; ;
; .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及正确的表示方法,明确离子化合物中阴离子需要标出最外层电子,阳离子直接用离子符号表示.

练习册系列答案
相关题目
12.已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
| A. | A、B、D不可能在同周期 | B. | C和D的单质可能化合为离子化合物 | ||
| C. | A、D可能在同一主族 | D. | D一定在第二周期 |
10.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图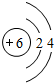 .
.
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为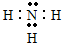 .
.
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
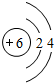 .
.(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
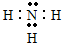 .
.(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
4.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.

已知:各离子开始沉淀及完全沉淀时的pH如表所示.
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)物质A最好使用下列物质中的B.
A.KMnO4B.H2O2C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.

已知:各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)物质A最好使用下列物质中的B.
A.KMnO4B.H2O2C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
5.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
下列判断不正确的是( )
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A. | 实验①反应后的溶液中:c(HA)=c(OH-)-c(H+) | |
| B. | 实验①反应后的溶液中:c(OH-)=c(K+)+c(H+)-c(A-) | |
| C. | 实验②反应后的溶液中:c(A-)+c(HA)>0.2mol•L-1 | |
| D. | 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.


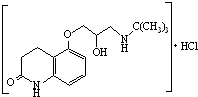 )可用于治疗心绞痛和青光眼.
)可用于治疗心绞痛和青光眼.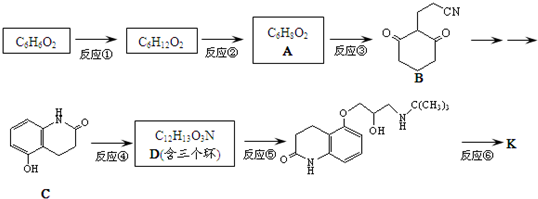
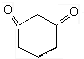 D
D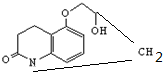
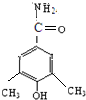
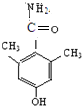 、
、
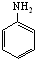 )与HNO2和H3PO2反应可得苯.请设计从C合成
)与HNO2和H3PO2反应可得苯.请设计从C合成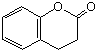 的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)