题目内容
16.下列大小顺序排列不正确的组合是( )| A. | 气态氢化物的稳定性:HCl>HBr>HI | B. | 离子半径:S2->Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>干冰 |
分析 A、非金属性越强,氢化物越稳定;
B、电子层数越多半径越大,电子层数相同时核电荷数越多半径越小;
C、中心元素非金属性越强,最高价氧化物对应水化物的酸性越强;
D、不同类型的晶体熔点:原子晶体>离子晶体>分子晶体.
解答 解:A、非金属性:Cl>Br>I,因此氢化物的稳定性:HCl>HBr>HI,故A正确;
B、相同电子层结构的微粒,核电核数大的半径小,O2->Na+,即S2->O2->Na+,故B错误;
C、非金属性:Cl>S>P,则最高价含氧酸酸性:HClO4>H2SO4>H3PO4,故C正确;
D、SiO2是原子晶体,NaCl是离子晶体,干冰是分子晶体,一般有熔点:原子晶体>离子晶体>分子晶体,故D正确;
故选B.
点评 本题考查同周期及同主族元素性质的递变规律、晶体类型与性质、半径比较等,难度中等,注意规律的掌握与理解.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
7.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.回答下列问题:
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
分析上表中的相关数据,请回答:NH3的沸点比PH3的高的原因是NH3存在分子间氢键;CH4的分解温度比SiH4的高的原因是C-H键的键能大于Si-H键的键能.
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图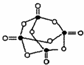 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH, (PAN)等二次污染物.
(PAN)等二次污染物.
①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图
 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH,
 (PAN)等二次污染物.
(PAN)等二次污染物.①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
4.下列说法正确的是( )
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
8.下列各项中“操作或现象”能达到预期“实验目的”的是( )
| 选项 | 目 的 | 操作或现象 |
| A | 制备无水FeCl3 | 将FeCl3溶液加热蒸干 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 证明非金属性Cl>C>Si | 向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D | 测定NaCl中混有Na2CO3的量 | 取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
| A. | A | B. | B | C. | C | D. | D |
5.回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
6.在一定条件下,发生反应:aA(g)+bB(g)?cC(g)△H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:
依据图表判断该反应△H<0(填“>”或“<”);若其他条件保持一定,降低温度,该反应物A的转化率增大(填“增大”、“减小”或“不变”,下同),化学反应速率将减小.
| T/℃ | 400 | 500 | 800 | 1 000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
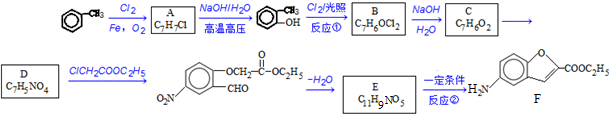
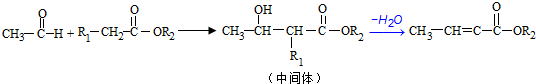
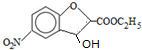 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;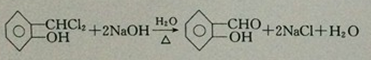 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为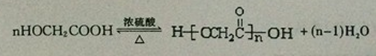 ;
;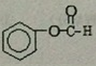 .
.