题目内容
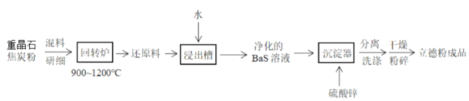
【题目】以重晶石(BaSO4)为原料,可按如下工艺生产立德粉(ZnS·BaSO4):
下列说法不正确的是
A.在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为BaSO4+4C![]() BaS+4CO↑
BaS+4CO↑
B.回转炉尾气中含有有毒气体,生产上可通过水蒸气变换将其转化为CO2和一种清洁能源气体,该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
C.在潮湿空气中长期放置的“还原料”。会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的BaSO4
D.沉淀器中发生的离子反应方程式为:S2-+Ba2++Zn2++SO42-=ZnS·BaSO4↓
【答案】C
【解析】
A选项,根据前后之间的联系可知在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为BaSO4+4C![]() BaS+4CO↑,故A正确;
BaS+4CO↑,故A正确;
B选项,回转炉尾气中含有有毒气体,生产上可通过水蒸气变换将其转化为CO2和一种清洁能源气体,该反应的化学方程式为CO+H2O![]() CO2+H2,故B正确;
CO2+H2,故B正确;
C选项,在潮湿空气中长期放置的“还原料”,硫化钡与空气中二氧化碳和水反应生成硫化氢、碳酸钡,逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的碳酸钡,故C错误;
D选项,净化的硫化钡溶液易溶,在沉淀器中发生的离子反应方程式为:S2-+Ba2++Zn2++SO42-=ZnS·BaSO4↓,故D正确。
综上所述,答案为C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目