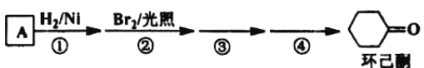
题目内容
【题目】25℃,几种物质的pH和浓度如下表所示。回答下列问题:
序号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
浓度 | c1 | c2 | c3 | c4 |
(1)c1____(填“>”“<”或“=”)c2。
(2)溶液中水的电离程度②____(填“>”“<”或“=”)③。
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为____(填序号)。
(4)①溶液与④溶液等体积混合,溶液的pH____7(填“>”“<“或“=”),用④溶液滴定①溶液,滴定过程中不可能出现的结果是____。
A. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(5)氢氧化铜悬浊液中有如下平衡:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液使之pH>_____。
Cu2+(aq)+2OH-(aq),常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液使之pH>_____。
【答案】> = ①>②>④>③ > C 5
【解析】
(1)pH=11氨水溶液中存在电离平衡,主要以电解质分子存在,c(OH-)=10-3 mol/L,c1>10-3 mol/L,pH=11氢氧化钠溶液中,由于氢氧化钠为一元强碱,完全电离,所以氢氧化钠溶液浓度c2=10-3 mol/L,所以c1>c2;
(2)pH=11氢氧化钠溶液中c(OH-)和pH=3醋酸溶液中c(H+)相同,则二者对水的抑制程度相同,所以溶液中水的电离程度②=③;
(3)pH=11氨水、pH=11氢氧化钠溶液、pH=3醋酸溶液、pH=3盐酸,稀释10倍,弱电解质溶液中电解质的电离平衡正向移动,促进电离,溶液中溶质电离出的离子浓度减小的少,pH变化小,所以溶液pH由大到小的顺序:①>②>④>③;
(4)由于一水合氨是弱电解质,在溶液中存在电离平衡,所以pH=11氨水中c(NH3·H2O)>c(OH-)=10-3 mol/L,HCl是一元强酸,完全电离,所以pH=3盐酸溶液中c(HCl)=c(H+)=10-3 mol/L,二者等体积混合,NH3·H2O过量,反应后溶液为NH3·H2O和NH4Cl的混合溶液,过量的一水合氨又电离产生OH-,所以最终达到平衡时,溶液中c(OH-)>c(H+),溶液显碱性,pH>7;
A. 反应后溶液为NH3·H2O和NH4Cl的混合溶液,若溶液中溶质的物质的量浓度关系为c(NH4Cl )≥c(NH3·H2O),则离子浓度符合关系c(NH4+)>c(Cl-)>c(OH-)>c(H+),A正确;
B. 若二者混合后溶液显中性,则符合关系:c(NH4+)=c(Cl-)>c(OH-)=c(H+),B正确;
C. 由于溶液显电中性,c(Cl-)>c(NH4+)>c(OH-)>c(H+)中阴离子浓度大于阳离子浓度,违背电荷守恒,所以任何情况下都不可能存在这种关系,C错误;
D. 若溶液为HCl和NH4Cl的混合溶液,且c(HCl)< c(NH4Cl ),则离子浓度符合c(Cl-)>c(NH4+)>c(H+)>c(OH-),D正确;
E. 若溶液为HCl和NH4Cl的混合溶液,且c(HCl)>c(NH4Cl ),则离子浓度符合c(Cl-)>c(H+)>c(NH4+)>c(OH-),D正确;
故合理选项是C;
(5)由于Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2×10-20。若某硫酸铜溶液里c(Cu2+)=0.02 mol/L,要形成Cu(OH)2沉淀,则溶液中c(OH-)≥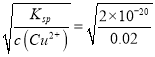 mol/L=1×10-9 mol/L,所以c(H+)≤10-5 mol/L,故溶液pH) ≥5。
mol/L=1×10-9 mol/L,所以c(H+)≤10-5 mol/L,故溶液pH) ≥5。

【题目】1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
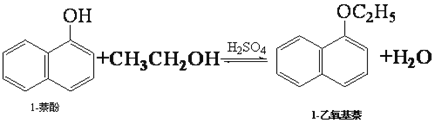
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
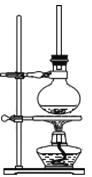
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是________。
(2)装置中长玻璃管的作用是:______________。
(3)该反应能否用实验室制备乙酸乙酯的装置_____(选填“能”或“不能”),简述理由_____________。
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是____________(选填编号)。
a.③②④① b.①②③④ c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是____________。

(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为________。