��Ŀ����
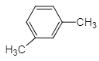
����Ŀ������ͪ�ǹ�ҵ����Ҫ�����л��ϳɵ�ԭ���ܼ��������������A����ͼ�����Ƶã�
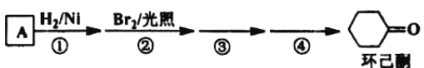
�ش��������⣺
��1����Ӧ�ٵķ�Ӧ����Ϊ___��Ӧ���۵ķ�Ӧ����Ϊ___��
��2����Ӧ�����õ��Լ�Ϊ___��
��3��A��ͬϵ�C8H10�����п��ܵĽṹ��ʽΪ___��
��4������ͪ�Ļ�ԭ���������������������������д����������������___��
��5��д��A������ͬϵ��ϳ�![]() �ĺϳ�·��___��
�ĺϳ�·��___��
�ϳ�·�ߵij��ñ�ʾ��ʽΪ��A![]() B����
B����![]() Ŀ����
Ŀ����
���𰸡��ӳ� ȡ�� Cu/O2���� ![]() ��
�� ��
�� ��
��![]() Ũ���ᣬ����
Ũ���ᣬ���� ![]()
![]()
![]()
![]()
![]()
![]()
![]() ��
��
��������
��ķ�����Ϊ![]() ���������ӳ�����
���������ӳ�����![]() ����Br2�ڹ��������·���ȡ����Ӧ�����ݻ���ͪ�Ľṹ��ʽ��֪ȡ������Ϊ
����Br2�ڹ��������·���ȡ����Ӧ�����ݻ���ͪ�Ľṹ��ʽ��֪ȡ������Ϊ![]() �����������ƴ���Һ������������ȡ����Ӧ����
�����������ƴ���Һ������������ȡ����Ӧ����![]() ��֮���ǻ������������ɻ���ͪ��
��֮���ǻ������������ɻ���ͪ��
��1����Ӧ��Ϊ�����ļӳɷ�Ӧ����Ӧ��Ϊ±������ȡ����Ӧ��
��2����Ӧ��Ϊ�ǻ��Ĵ���������ҪCu/O2���ȣ�
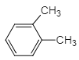
��3��AΪ![]() ����ͬϵ�����ʽΪC8H10��������DZ�������һ���һ����������������п��ܵĽṹ��ʽΪ
����ͬϵ�����ʽΪC8H10��������DZ�������һ���һ����������������п��ܵĽṹ��ʽΪ![]() ��
�� ��
�� ��
��![]() ��
��
��4�����������֪����ͪ���Ի�ԭ�����Ҵ����Ҵ���Ũ������ȵ������¿��������ᷴӦ��������
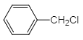
��5��A������ͬϵ��Ϊ![]() �������ڹ���������±�嵥�ʷ���ȡ����Ӧ��֮��±ԭ�ӷ���ȡ����Ӧ���ɱ��״���֮���ٽ��б����ļӳ�����
�������ڹ���������±�嵥�ʷ���ȡ����Ӧ��֮��±ԭ�ӷ���ȡ����Ӧ���ɱ��״���֮���ٽ��б����ļӳ�����![]() �����Ժϳ�·��Ϊ��
�����Ժϳ�·��Ϊ��![]()
![]()
![]()
![]()
![]()
![]() ��
��

����Ŀ������������(NOx)�Ǵ�����Ⱦ��֮һ����ҵ����һ���¶Ⱥʹ�����������NH3��NOx��ԭ����N2��ijͬѧ��ʵ�����ж�NH3��NOx��Ӧ������̽�����ش��������⣺
��1���������Ʊ�

�ٰ����ķ���װ�ÿ���ѡ����ͼ�е�________����Ӧ�Ļ�ѧ����ʽΪ______________��
��Ԥ�ռ�һƿ����İ�����ѡ����ͼ�е�װ�ã�������˳��Ϊ������װ����______(������������Сд��ĸ��ʾ)��
��2����������������ķ�Ӧ�������ռ�����NH3����ע����X�У�Ӳ�ʲ�����Y�м�����������������NO2(�����ü���K1��K2�к�)����һ���¶��°�ͼʾװ�ý���ʵ�顣

�������� | ʵ������ | ����ԭ�� |
��K1���ƶ�ע����������ʹX�е����建��ͨ��Y���� | ��Y����_____________ | �ڷ�Ӧ�Ļ�ѧ����ʽ ____________ |
��ע���������˻�ԭ�����̶�����װ�ûָ������� | Y����������ˮ�� | ���ɵ���̬ˮ���� |
��K2 | ��_______________ | ��______________ |
����Ŀ����. ��֪��CO �Ķ��Ա����� CO ��Ѫ�쵰�ף�Hb����ϳ�Hb��CO��ʹѪ�쵰��ʧȥ���� O2���ܡ�CO����ѪҺ��������ƽ�⣺CO��Hb��O2![]() O2��Hb��CO����֪���������� 37���£���ƽ�ⳣ��Ϊ 220���Իش�
O2��Hb��CO����֪���������� 37���£���ƽ�ⳣ��Ϊ 220���Իش�
��1��ú���ж����ˣ�����ͨ�������ѹ���յķ��������Σ����û�ѧƽ���ԭ������˵����______��
��2������ʱ������β��Ŀ�����c��CO����10-6mol��L-1��c��O2����10��2mol��L-1����c��Hb��CO��Ϊc��Hb��O2����___________����
��3����֪��ѪҺ��c��Hb��CO��/c��Hb��O2���ı�ֵ���� 0.02ʱ���˵�������ܿ��ܵ����ˣ�Ϊ�����˵������ܵ����ˣ�c��O2����c��CO���ı�ֵӦ����_____��
��.��ijһ�¶������£� Bodensteins �о��˷�Ӧ��2HI��g��![]() H2��g�� ��I2��g�������������� HI �����ʵ���Ũ��x��HI����mol��L-1���뷴Ӧʱ��t�Ĺ�ϵ���±���
H2��g�� ��I2��g�������������� HI �����ʵ���Ũ��x��HI����mol��L-1���뷴Ӧʱ��t�Ĺ�ϵ���±���
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
��һ������ | x��HI�� | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
�ڶ������� | x��HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
��4����������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ_________��
��5��������Ӧ������Ӧ����Ϊv��=k��x2��HI�����淴Ӧ����Ϊv��=k��x��H2����x��I2��������k����k��Ϊ���ʳ�������k��Ϊ_________����K��k����ʾ������k��=0.002��min��1����һ��ʵ��ʱ����t=20 min��v��=___________��
����Ŀ��I. �л���A���������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������AΪ��ɫҺ�壬������ˮ��Ϊ�о�A �������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
�ٳ�ȡ9.0gA������ʹ�������������ܶ�����ͬ������H2��45 �� | ��ͨ��������գ���1��A����Է�������Ϊ________ |
�ڽ���9.0gA��������O2�г�� ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g | ��2��A�ķ���ʽΪ________ |
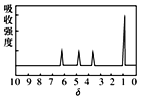
����֪A���й�������COOH����OH����A�ĺ˴Ź���������ͼ�� |
|
��3������������A�Ľṹ��ʽΪ________ | |
II. ��ҵ�ϳ���A����Ϊԭ�Ϻϳ�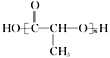 ���÷�Ӧ��������______������ĸ���ţ���ͬ����Ӧ��
���÷�Ӧ��������______������ĸ���ţ���ͬ����Ӧ��
A �Ӿ� B ����
III. ���й������ʵķ��롢�ᴿʵ���е�һЩ��������������ȷ����_______��
A ����װ����װ��ʱ���¶ȼƵ�ˮ����Ӧ����Һ����
B ��96%�Ĺ�ҵ�ƾ���ȡ��ˮ�Ҵ�ʱ���ȼ�����ˮCuSO4���ٹ���
C �ڱ������ؽᾧʵ���У��ֱ���������ܽ��Ҫ������������ˮ
D �ڱ������ؽᾧʵ���У����ֱ�������ȫ�ܽ��Ҫ��ȴ�������ٹ���
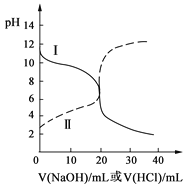
����Ŀ��25�����������ʵ�pH��Ũ�����±���ʾ���ش��������⣺
��� | �� | �� | �� | �� |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
pH | 11 | 11 | 3 | 3 |
Ũ�� | c1 | c2 | c3 | c4 |
(1)c1____������>����<������=����c2��
(2)��Һ��ˮ�ĵ���̶���____������>����<������=��������
(3)�ֱ��ˮϡ��10����ϡ�ͺ�������Һ��pH�ɴ�С��˳��Ϊ____������ţ���
(4)����Һ������Һ�������ϣ���Һ��pH____7������>����<������=������������Һ�ζ�����Һ���ζ������в����ܳ��ֵĽ����____��
A. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(5)������ͭ����Һ��������ƽ�⣺Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq)�������£�Ksp=c(Cu2+)��c2(OH-)=2��10-20��ij����ͭ��Һ��c(Cu2+)=0.02 mol/L����Ҫ����Cu(OH)2������Ӧ������Һʹ֮pH>_____��
Cu2+(aq)+2OH-(aq)�������£�Ksp=c(Cu2+)��c2(OH-)=2��10-20��ij����ͭ��Һ��c(Cu2+)=0.02 mol/L����Ҫ����Cu(OH)2������Ӧ������Һʹ֮pH>_____��