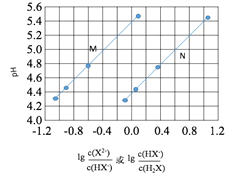
题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
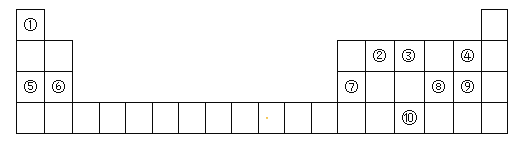
(1)元素⑩在周期表中的位置是_____,⑦的原子结构示意图为_____。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为______(用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是______(用化学式表示),最高价氧化物对应水化物中,酸性最强的是_____(用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式___。
(5)由①③⑨组成的离子化合物的化学式为____,其中含有的化学键类型是______。
【答案】第四周期第VA族 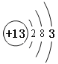 F->Na+>Mg2+ HF HClO4 Al(OH)3+OH-=[Al(OH)4]- NH4Cl 离子键、共价键
F->Na+>Mg2+ HF HClO4 Al(OH)3+OH-=[Al(OH)4]- NH4Cl 离子键、共价键
【解析】
根据各元素在周期表中的相对位置可知:①为H元素、②为C元素、③为N元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为S元素、⑨为Cl元素,⑩为As元素,据此结合元素周期律知识解答。
根据各元素在周期表中的相对位置可知:①为H元素、②为C元素、③为N元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为S元素、⑨为Cl元素,⑩为As元素。
(1)⑩为As元素,在元素周期表的位置位于第四周期第VA族;⑦是Al元素,原子核外电子排布是2、8、3,所以Al的原子结构示意图为 ;
;
(2))④、⑤、⑥三种元素分别是F、Na、Mg,三种元素的简单离子都具有2、8的电子层结构,电子层结构相同。对于电子层结构相同的离子来说,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为F->Na+>Mg2+;
(3)④⑧⑨分别是F、S、Cl,元素的非金属性越强,其相应的氢化物的稳定性就越强,由于元素的非金属性F>Cl>S,所以三种元素的气态氢化物中,最稳定的是HF;
F元素没有最高价的含氧酸,由于元素的非金属性Cl>S,所以最高价氧化物对应水化物中,酸性最强的是HClO4;
(4)⑤是Na,⑦是Al,两种元素的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,Al(OH)3是两性氢氧化物,可以与强碱NaOH发生反应产生四羟基合铝酸钠,发生反应的离子方程式Al(OH)3+OH-=[Al(OH)4]-;
(5)①是H,③是N,⑨是Cl,由①③⑨组成的离子化合物是氯化铵,化学式为NH4Cl,该物质是离子化合物,NH4+与Cl-之间通过离子键结合,NH4+中的N、H原子间通过共价键结合,所以其中含有的化学键类型是离子键、共价键。