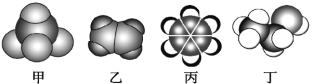
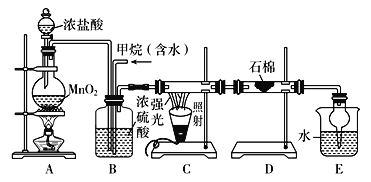
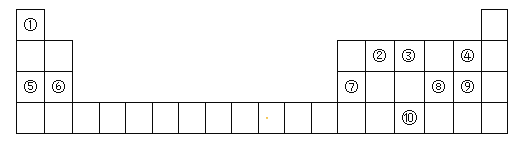
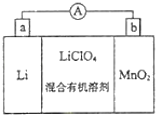
题目内容
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
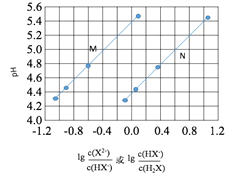
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
【答案】D
【解析】A、己二酸是二元弱酸,第二步电离小于第一步,即Ka1=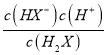 >Ka2=
>Ka2=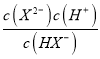 ,所以当pH相等即氢离子浓度相等时
,所以当pH相等即氢离子浓度相等时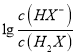 >
>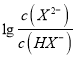 ,因此曲线N表示pH与
,因此曲线N表示pH与 的变化关系,则曲线M是己二酸的第二步电离,根据图像取-0.6和4.8点,
的变化关系,则曲线M是己二酸的第二步电离,根据图像取-0.6和4.8点, 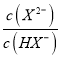 =10-0.6mol·L-1,c(H+)=10-4.8mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2(H2X)的数量级为10-6,A正确;B.根据以上分析可知曲线N表示pH与
=10-0.6mol·L-1,c(H+)=10-4.8mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2(H2X)的数量级为10-6,A正确;B.根据以上分析可知曲线N表示pH与 的关系,B正确;C. 曲线N是己二酸的第一步电离,根据图像取0.6和5.0点,
的关系,B正确;C. 曲线N是己二酸的第一步电离,根据图像取0.6和5.0点, 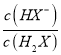 =100.6mol·L-1,c(H+)=10-5.0mol·L-1,代入Ka1得到Ka2=10-4.4,因此HX-的水解常数是10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),C正确;D.根据图像可知当
=100.6mol·L-1,c(H+)=10-5.0mol·L-1,代入Ka1得到Ka2=10-4.4,因此HX-的水解常数是10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),C正确;D.根据图像可知当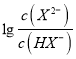 =0时溶液显酸性,因此当混合溶液呈中性时,
=0时溶液显酸性,因此当混合溶液呈中性时, 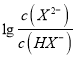 >0,即c(X2-)>c(HX-),D错误;答案选D。
>0,即c(X2-)>c(HX-),D错误;答案选D。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)。下列计算结果正确的是
编号 | ① | ② | ③ | ④ |
硝酸体积/mL | 100 | 200 | 300 | 400 |
剩余金属/g | 18.0 | 9.6 | 0 | 0 |
NO体积/L | 2.24 | 4.48 | 6.72 | V |
A. ①中溶液存在Fe3+ B. 硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D. ④中V=6.72