题目内容
【题目】如图是元素周期表的一部分,下列叙述不正确的是
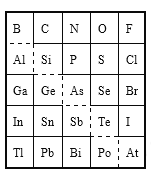
A. Sn的最高正价为+4
B. Br的最高价氧化物对应水化物的化学式为HBrO3
C. 酸性强弱:H3AsO4<H2SeO4
D. 原子半径比较:N<Si
【答案】B
【解析】
A. Sn原子最外层有4个电子,因此Sn的最高正价为+4,A正确;
B.Br原子最外层有7个电子,所以Br的最高价氧化物对应水化物的化学式为HBrO4,B错误;
C.As、Se是同一周期的元素,随着原子序数的增大,元素的非金属性逐渐增强,因此元素最高价氧化物对应的水化物的酸性逐渐增强,所以酸性:H3AsO4<H2SeO4,C正确;
D.同一周期的元素,原子序数越大,原子半径越小,同一主族的元素,原子序数越大,原子半径越大,所以原子半径Si>P>N,D正确;
故合理选项是B。

练习册系列答案
相关题目