题目内容
12.钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图: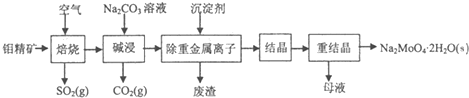
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:增大钼精矿与空气接触,使其充分反应,提高原料的利用率.
(2)写出焙烧时生成MoO3的化学方程式为:2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2.
(3)写出“碱浸”反应的离子方程式:MoO3+CO32-=MoO42-+CO2↑.
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-.当BaMoO4开始沉淀时,求SO42-的去除率(写出计算过程).已知:碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.040mol•L-1,Ksp(BaSO4)=1.0×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略.
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
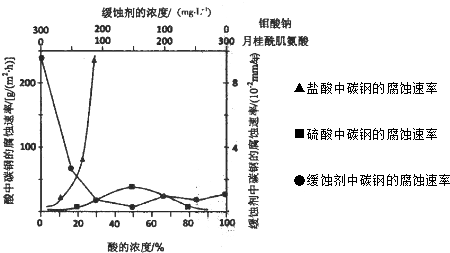
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;或(硫酸随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢).
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4~Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2,则NaNO2的作用是替代空气中氧气起氧化剂作用.
分析 灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O,
(1)反应物接触时间越长,反应越充分;
(2)焙烧时MoS2发生氧化反应生成MoO3;
(3)碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠;
(4)根据据钼酸钡和硫酸钡的溶度积计算出溶液中硫酸根离子的浓度,再计算出SO42-的去除率;
(5)①根据图片知,如果相同浓度时,硫酸中氢离子浓度大于HCl中,但盐酸腐蚀速率远远大于硫酸腐蚀速率,说明氯离子影响腐蚀速率远远大于硫酸根离子影响腐蚀速率;
②NaNO2具有氧化性.
解答 解:灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O,
(1)反应物接触时间越长,反应越充分,焙烧的过程中采用的是“逆流焙烧”的措施,该措施优点是增大钼精矿与空气接触,使其充分反应,提高原料的利用率,
故答案为:增大钼精矿与空气接触,使其充分反应,提高原料的利用率;
(2)焙烧时MoS2发生氧化反应生成MoO3同时生成二氧化硫,反应方程式为2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,
故答案为:2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2;
(3)碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,离子方程式为MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(4)当BaMoO4开始沉淀时,c(Ba2+)=$\frac{{K}_{sp}(BaMo{O}_{4})}{c(Mo{{O}_{4}}^{2-})}$=$\frac{4.0×1{0}^{-8}}{0.40}$mol/L=1.0×10-7mol•L-1,
此时c(SO42-)=$\frac{1.0×1{0}^{-10}}{1.0×1{0}^{-7}}$mol/L=1.0×10-3mol•L-1,
SO42-的去除率=$\frac{0.040-1.0×1{0}^{-3}}{0.040}$×100%=97.5%,
答:硫酸根离子的去除率为97.5%;
(5)①根据图片知,如果相同浓度时,硫酸中氢离子浓度大于HCl中,但盐酸腐蚀速率远远大于硫酸腐蚀速率,说明Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;或(硫酸随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢 ),
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;或(硫酸随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢 );
②NaNO2具有氧化性,能代替空气中氧气起到氧化剂作用,从而导致碳钢管道缓蚀,
故答案为:替代空气中氧气起氧化剂作用.
点评 本题考查混合物的分离和提纯,为高频考点,侧重考查流程图中操作过程、物质性质、图象分析等,明确操作基本原理及物质的性质是解本题关键,同时考查学生分析判断及知识综合应用能力,难点是溶度积常数的有关计算,题目难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH2=CHCH2CH3 丁烯 | ||
| C. | 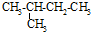 异戊烷 异戊烷 | D. |  4-甲基-2-戊烯 4-甲基-2-戊烯 |
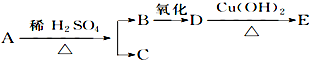 其中B、C的相对分子质量相等,则A的可能的结构简式有( )
其中B、C的相对分子质量相等,则A的可能的结构简式有( )| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
| A. | 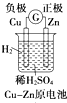 | B. | 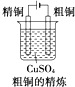 | C. | 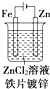 | D. | 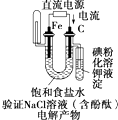 |
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 18gD2O含有10NA个质子 | |
| C. | 标准状况下,2.24L CCl4中含有C-Cl 0.4 NA | |
| D. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
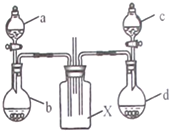 只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )
只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )| 选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 | X中的物质 |
| A | 浓硝酸 | Fe | 稀盐酸 | Na2S | H2SO4 |
| B | 稀硫酸 | Zn | 浓盐酸 | MnO2 | HCl |
| C | 浓硫酸 | C2H5OH | 溴单质 | CCl4 | CH2BrCH2Br |
| D | 浓硫酸 | 浓盐酸 | 浓氨水 | CaO | NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 | |
| C. | 温度越高反应速率越快,平衡时生成的SO3越多 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |