题目内容
1.元素在周期表中的位置,能反映原子结构和元素的化学性质,下列有关说法正确的是( )| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
分析 A.位于金属与非金属交界处的元素,有金属性和非金属性;
B.主族和零族由长、短周期元素共同组成,短周期为一、二、三周期;
C.短周期元素原子形成简单离子后,可能为最外层2电子稳定结构;
D.同位素的物理性质不同,化学性质相同.
解答 解:A.位于金属与非金属交界处的元素,有金属性和非金属性,如Si元素等,既表现金属性,又表现非金属性,故A错误;
B.主族和零族由长、短周期元素共同组成,短周期为一、二、三周期,过渡元素由长周期元素组成,故B正确;
C.短周期元素原子形成简单离子后,可能为最外层2电子稳定结构,也可能为最外层电子8电子稳定结构,如Li、Na的离子结构,故C错误;
D.互为同位素的不同核素,物理性质不同,因为质子数及原子结构相同,则化学性质相同,故D错误;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置及性质为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
16.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
| A. | v(A2)=0.4 mol/L•s | B. | v(B2)=0.8mol/L•s | C. | v(C)=0.6 mol/L•s | D. | v(D)=0.1 mol/L•s |
13.下列有机反应中,属于消去反应的是( )
| A. | 苯酚与浓溴水混合 | B. | 溴丙烷与NaOH溶液混合,静置 | ||
| C. | 乙醛与新制的银氨溶液水浴加热 | D. | 1-氯丁烷与乙醇、KOH共热 |
10.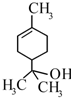 萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
 萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )| A. | 分子式为C9H18O | |
| B. | 分子中含有的官能团为羟基和碳碳双键 | |
| C. | 该物质能和乙酸发生取代反应 | |
| D. | 1mol该物质最多能和1mol氢气发生加成反应 |
11.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | NA个氧分子和NA个氢分子的质量比等于8:1 | |
| B. | 11.2L H2中含有的原子数为NA个 | |
| C. | 54g H2O中含有分子数为3NA个 | |
| D. | 1mol/L Na2SO4溶液中SO42-离子数为NA个 |
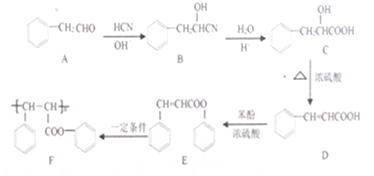
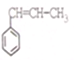 系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.
系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.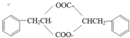 ;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式
;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式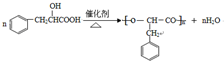 .
.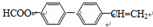 .
.