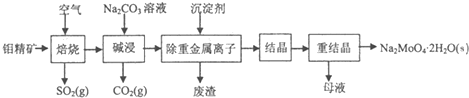
题目内容
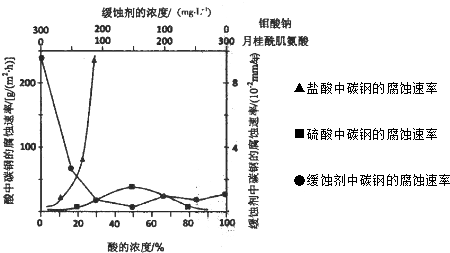
7.如图是有关电化学的图示,其中完全正确的是( )| A. | 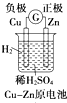 | B. | 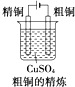 | C. | 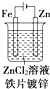 | D. | 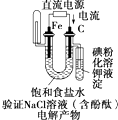 |
分析 A.依据原电池原理分析,活泼金属做负极;
B.粗铜精炼,粗铜做阳极,精铜做阴极;
C.依据电镀原理,镀层金属做阳极,待镀金属做阴极;
D.电解饱和食盐水,铁棒为阴极,电解过程中生成氢气,碳棒做电解池阳极,溶液中氯离子失电子生成氯气.
解答 解:A.锌比铜活泼,应为负极,铜为正极,故A错误;
B.粗铜精炼,粗铜做阳极,精铜做阴极,故B错误;
C.镀件铁做阴极,锌做阳极进行电镀,故C错误;
D.电解饱和食盐水,阳极电流流向,铁棒为阴极,电解过程中生成氢气,碳棒做电解池阳极,溶液中氯离子失电子生成氯气,检验氯气用淀粉碘化钾,故D正确;
故选D.
点评 本题考查了原电池和电解池原理的分析判断,为高频考点,侧重于学生的分析能力的考查,注意把握电极反应和电极判断,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法中正确的是( )
| A. | 随着原子序数的递增,第三周期元素的电负性逐渐减小 | |
| B. | 铝的第一电离能比镁的第一电离能大 | |
| C. | K、Na、Li的第一电离能逐渐增大 | |
| D. | 电负性差值大的元素原子之间形成的化学键主要是共价键 |
18.25℃的四种溶液:①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,有关上述溶液的说法,正确的是( )
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② | |
| D. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
15.下列物质加热熔化时,所克服粒子间相互作用力属于同类型的是( )
| A. | 食盐和金属钠的熔化 | B. | 氯化铵和单质硫的熔化 | ||
| C. | 碘和干冰的升华 | D. | 金刚石和石灰石的熔化 |
2.央视《每周质量报告》报道某著名制药企业使用工业明胶制造有毒胶囊,其中铬元素含量超标.铬是人体必需的微量元素,它与脂类代谢有密切关系,能增强人体内胆固醇的分解和排泄.但铬过量会引起污染,危害人类健康.不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.一种处理方法的工艺流程为

回答下列问题:
(1)初沉池中加入的混凝剂是明矾,用于吸附悬浮杂质,用离子方程式表示其道理Al3++3H2O?Al(OH)3+3H+.
(2)若在化学实验室中模拟第②步操作A,则进行该操作所需的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)已知在其中第③步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
若平衡体系的pH=1,该溶液是橙色;能说明第③步反应达平衡状态的是C(填序号).
A.Cr2O72-与CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(4)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,且有关离子完全沉淀的pH如下表:
在操作④和操作⑤中,加入Fe2SO4,再调节pH,使Fe3+和Cr3+完全沉淀.则可用于调节溶液pH的最佳试剂为C填序号.
A.Na2O2 B.Ba(OH)2 C.NaOH
此时溶液pH的范围在B(填序号)最好.
A.3-4 B.6-8 C.10-11 D.12-14.
(5)若按照(4)题方法处理Cr2O72-,则处理该溶液中0.1molCr2O72-时,理论上可生成沉淀的质量为84.8g.
(6)工业上还可以用石墨作电极,电分解Na2CrO4的酸性废水来生产金属铬,写出生成金属铬的电极反应式CrO42-+8H++6e-=Cr+4H2O.

回答下列问题:
(1)初沉池中加入的混凝剂是明矾,用于吸附悬浮杂质,用离子方程式表示其道理Al3++3H2O?Al(OH)3+3H+.
(2)若在化学实验室中模拟第②步操作A,则进行该操作所需的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)已知在其中第③步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
若平衡体系的pH=1,该溶液是橙色;能说明第③步反应达平衡状态的是C(填序号).
A.Cr2O72-与CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(4)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,且有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀时的pH | 9.0 | 3.2 | 5.6 |
A.Na2O2 B.Ba(OH)2 C.NaOH
此时溶液pH的范围在B(填序号)最好.
A.3-4 B.6-8 C.10-11 D.12-14.
(5)若按照(4)题方法处理Cr2O72-,则处理该溶液中0.1molCr2O72-时,理论上可生成沉淀的质量为84.8g.
(6)工业上还可以用石墨作电极,电分解Na2CrO4的酸性废水来生产金属铬,写出生成金属铬的电极反应式CrO42-+8H++6e-=Cr+4H2O.
19.某些牙膏中含有的消毒剂三氯生遇含氯自来水能生成三氯甲烷,哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图.有关说法正确的是( )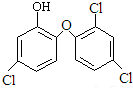

| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 三氯甲烷只有一种结构,可推知CH4是正四面体 | |
| C. | 三氯生能与NaOH溶液反应 | |
| D. | 常温下,三氯生易溶于水 |
16.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
| A. | v(A2)=0.4 mol/L•s | B. | v(B2)=0.8mol/L•s | C. | v(C)=0.6 mol/L•s | D. | v(D)=0.1 mol/L•s |
17.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |