题目内容
【题目】实验室取用KClO3和MnO2的混合物(共33.2g),加热至恒重,将反应后的固体加30g水充分溶解,剩余固体13.1g(t℃),再加10g水充分溶解,仍剩余固体9.6g(t℃)。
(1)若剩余的9.6g固体全是MnO2,且溶液的体积为VL,则此时c(K+)为______。(结果用含V的最简化代数式表示)
(2)若剩余的9.6g固体是MnO2和KCl的混合物,则混合物中KClO3的质量为______。
【答案】![]() mol/L 24.5g
mol/L 24.5g
【解析】
(1)若剩余的9.6g固体全是MnO2,m(KClO3)=33.2g-9.6g,结合n=![]() 、c=
、c=![]() 计算;
计算;
(2)若剩余的9.6g固体是MnO2和KCl的混合物,反应前后质量减少的质量为氧气的质量,根据氯酸钾和氧气之间的关系式计算氯酸钾的质量。
(1)若剩余的9.6g固体全是MnO2,m(KClO3)=33.2g-9.6g=23.6g,n(K+)=n(KClO3)=![]() =
=![]() mol,则c(K+)=
mol,则c(K+)=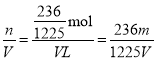 mol/L;
mol/L;
(2)若剩余的9.6g固体是MnO2和KCl的混合物,则10g水溶解氯化钾得到的溶液是饱和溶液,10g水溶解KCl的质量=13.1g-9.6g=3.5g,40g水溶解氯化钾的质量=3.5g×4=14g,反应前后质量减少的质量为氧气的质量,说明生成氧气的质量为:33.2g-14g-9.6g=9.6g,根据氧原子守恒得:n(KClO3)=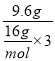 =0.2mol,则原混合物中KClO3的质量为122.5g/mol×0.2mol=24.5g。
=0.2mol,则原混合物中KClO3的质量为122.5g/mol×0.2mol=24.5g。

练习册系列答案
相关题目