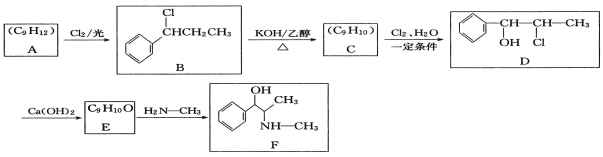
题目内容
【题目】(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
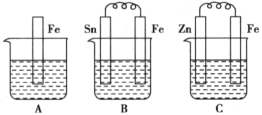
①B中Sn极的电极反应式为___________,Sn极附近溶液的pH________(填“增大”“减小”或“不变”)。
②C中总反应方程式为_________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是__________。
(2)如图是甲烷燃料电池工作原理示意图,回答下列问题:
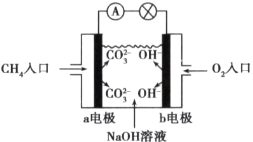
①电池的负极是__(填“a”或“b”)极,该极的电极反应式是___。
②电池工作一段时间后,电解质溶液的pH是____(填“增大”“减小”或“不变”)。
【答案】2H++2e-=H2↑ 增大 H2SO4+Zn = H2↑+ZnSO4 B>A>C a CH4 - 8e- +10OH- = CO32- + 7H2O 减小
【解析】
(2)甲烷燃料电池,通入甲烷的电极为负极,通入氧气的电极为正极,总反应是CH4+2O2+2NaOH=Na2CO3+3H2O。
(1) ①在B装置中,Fe、Sn、稀硫酸溶液构成原电池,金属性Fe大于Sn,则Sn为正极,Sn极上发生的电极反应式为2H++2e-=H2↑;Sn极附近溶液的氢离子浓度减小,pH增大;
②C中Zn、Fe、稀硫酸溶液构成原电池,锌是负极、铁是正极,总反应方程式为H2SO4+Zn = H2↑+ZnSO4;A中没有形成原电池,为铁的化学腐蚀,B中构成原电池,Sn极是正极、铁极是负极,C中构成原电池,锌是负极、铁是正极,原电池负极腐蚀速率>化学腐蚀速率>原电池正极腐蚀速率,则A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C;
(2)甲烷燃料电池,通入甲烷的电极为负极,通入氧气的电极为正极,总反应式为CH4+2O2+2NaOH=Na2CO3+3H2O。
①电池的负极是a电极,该极失电子发生氧化反应,电极反应式为CH4 - 8e- +10OH- = CO32- + 7H2O;
②根据总反应式可知,反应消耗氢氧化钠,电池工作一段时间后电解质溶液的pH减小。

 口算能手系列答案
口算能手系列答案