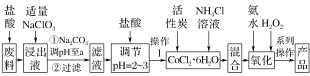
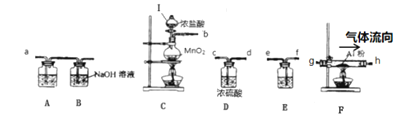
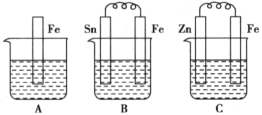
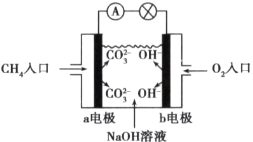
��Ŀ����
����Ŀ����. ��1��д����ʾ���� 8 �����ӡ�10 �����ӵ�ԭ�ӵĻ�ѧ����_____��
��2��ԭ��������_________������Ԫ��������_____������Ԫ�ص� ͬλ����_____������Ԫ�صĻ�ѧ������_________������
��.��![]() ��
��![]() ��
��![]() ��H2O��D2O ��ʯī�����ʯ��H��D��T �����������ʣ��ش���������:
��H2O��D2O ��ʯī�����ʯ��H��D��T �����������ʣ��ش���������:
��1����Ϊͬλ�ص���_____��
��2����Ϊͬ�����������_________��
��3���ɢٺ͢������ܽ�ϳɺ�����ԭ�ӵĻ������Щ���� ������Է�������������_________(�ѧʽ)��
���𰸡�![]() ������ ������ ������ ���������� �٢� ��
������ ������ ������ ���������� �٢� �� ![]()
��������
I����1����ԭ�ӵ�������=������+������=8+10=18����Ԫ�ص�������Ϊ8��ΪOԪ�أ���ԭ�ӵĻ�ѧ����Ϊ��![]() ��
��
��2��ԭ�ӵ���������������������������������������������������������������������������Ԫ���Ǿ�����ͬ����������˵��������һ��ԭ�ӵ��ܳƣ��������������йأ�ͬλ�ؼ���������ͬ����������ͬ��ԭ�ӣ���������������������Ԫ�صĻ�ѧ������ԭ�ӵ�ʧ�����йأ���ʧ�ĵ�����ԭ��������ϵĵ��ӣ�����Ԫ�صĻ�ѧ������Ҫ����������������;
II����1��ͬλ�ؼ���������ͬ����������ͬ��ԭ�ӣ�������Ϊͬλ�ص��ǣ��٢ܣ�
��2����ͬԪ����ɵIJ�ͬ�ֵ��ʻ�Ϊͬ�������壬������Ϊͬ����������ǣ��ۣ�
��3���ɢٺ͢������ܽ�ϳɺ�����ԭ�ӵĻ�����Ϊˮ���û��������Է���������ԭ�ӵ������������������Է������������ǣ�![]() ��
��

 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�