��Ŀ����
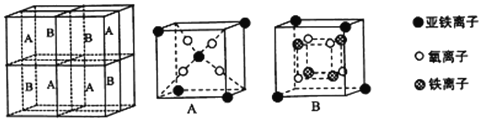
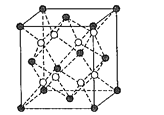
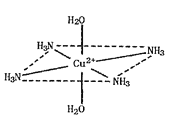
����Ŀ��������ͭ��Һ����εμ�Ũ��ˮ���ȳ�������a�������μ�Ũ��ˮ������a����ʧ���õ�һ�ֺ����������ӵ�����ɫ����Һ�����������Ҵ�����������ɫ�ľ���[Cu��NH3��4]SO4H2O�����ֶ��������ӵ�����ṹ��ͼ��ʾ��4��NH3��Cu2+���棬��H2O-Cu2+-H2O���ߴ�ֱ������ش��������⣺
��1����̬Cuԭ�ӵļ۵��ӹ����ʾʽ__��
��2������ͭˮ��Һ�μ�Ũ��ˮ�ı仯���̣�����a��__��д����������ɫ����Һ�����ӷ���ʽ�� __��
��3��NH3��Cu2+���γ�[Cu��NH3��4]2+�����ӡ���֪NF3��NH3������ͬ�Ŀռ乹�ͣ���NF3������Cu2+�γ������ӣ���ԭ����__��
��4�����ڶ��������ӵ�����ṹͼ������������ʾ�����е���λ��__��
��5����֪������CuO��Cu2O+O2����ͭԭ�Ӽ۲���ӽṹ�仯�Ƕ�������������Cu2O��ԭ����__��
���𰸡�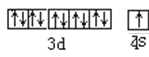 �γ���ɫ���� Cu��OH��2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O F�ĵ縺�Ա�N��N-F�ɼ����Ӷ�ƫ��F������NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ��
�γ���ɫ���� Cu��OH��2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O F�ĵ縺�Ա�N��N-F�ɼ����Ӷ�ƫ��F������NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ�� 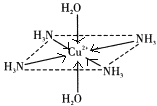 CuO��ͭ�ļ۲�����Ų�Ϊ3d9��Cu2O��ͭ�ļ۲�����Ų�Ϊ3d10�����ߴ����ȶ���ȫ����״̬��ǰ�߲���
CuO��ͭ�ļ۲�����Ų�Ϊ3d9��Cu2O��ͭ�ļ۲�����Ų�Ϊ3d10�����ߴ����ȶ���ȫ����״̬��ǰ�߲���
��������
(1)CuΪ29��Ԫ�أ��۵����Ų�Ϊ3d104s1��
(2)������ͭ��Һ�еΰ�ˮ����ˮ������ͭ��Ӧ��������������ͭ��ɫ����������ˮ����ʱ����ˮ��������ͭ��Ӧ���ɿ����Ե�ͭ������ע��������ӵ�����ṹ��֪����[Cu(NH3)4(H2O)2]2+���ӣ��ݴ���д����ʽ��
(3)NF3��N-F�ɼ����Ӷ�ƫ����Fԭ�ӣ�Nԭ���ϵŶԵ�������ͭ�����γ������ӣ�
(4)������У���λ���ṩ�µ��Ӷԣ�����ԭ���ṩ�չ���γ���λ����[Cu(NH3)4(H2O)2]2+�У�Cu2+�ṩ�չ����N��Oԭ���ṩ�¶Ե��ӣ��ݴ˱����ѧ����
(5)������CuO��Cu2O+O2��Cu2+�ļ۵���Ϊ3d9��Cu+�ļ۵���Ϊ3d10��������Cu+���ȶ���
(1)ͭ��29��Ԫ�أ��۵����Ų�Ϊ3d104s1������۵��ӹ����ʾʽΪ��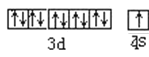 ��
��
(2)������ͭ��Һ�еΰ�ˮ����ˮ������ͭ��Ӧ��������������ͭ��ɫ������������a���γ���ɫ�����������μӰ�ˮ�������ܽ⣬��ˮ��������ͭ��Ӧ���ɿ����Ե�ͭ������ע��������ӵ�����ṹ��֪����[Cu(NH3)4(H2O)2]2+���ӣ���Ӧ�����ӷ���ʽΪ��Cu(OH)2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O��
(3)F�ĵ縺�Դ���NԪ�أ�NF3��N-F�ɼ����Ӷ�ƫ����Fԭ�ӣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ��Nԭ���ϵŶԵ�������ͭ�����γ������ӣ�����NF3������Cu2+�γ������ӣ�
(4)����ͭ�Ͱ�ˮ��Ӧ����������ͭ��ɫ�����������Ӱ�ˮʱ��������ͭ�Ͱ�ˮ������Ӧ��Cu2+�ṩ�չ����Nԭ���ṩ�¶Ե��ӣ�����������ʹ��Һ���壬[Cu(NH3)4(H2O)2]2+Ϊ�����ӣ�Cu2+�ṩ�չ����N��Oԭ���ṩ�¶Ե��ӣ�������λ����ϣ��˻�ѧ���ɱ�ʾΪ��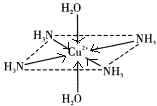 ��
��
(5)������CuO��Cu2O+O2��Cu2+�ļ۵���Ϊ3d9��Cu+�ļ۵���Ϊ3d10��������Cu+���ȶ�������ܹ�����Cu2O��ԭ����Խ���Ϊ��CuO��ͭ�ļ۲�����Ų�Ϊ3d9��Cu2O��ͭ�ļ۲�����Ų�Ϊ3d10�����ߴ����ȶ���ȫ����״̬��ǰ�߲��ǡ�

 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д�����Ŀ������(��Ҫ��Ⱦ��SO2��NOX)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ��������е�SO2��NOx �ĺ�����
(1) O3����������SO2��NOx ����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ�� NO(g)��O3(g)![]() NO2(g)+ O2(g) ��H����200.9 kJ��mol-13NO(g)��O3(g)
NO2(g)+ O2(g) ��H����200.9 kJ��mol-13NO(g)��O3(g)![]() 3NO2(g) ��H����317.3kJ��mol-1����2NO2(g)
3NO2(g) ��H����317.3kJ��mol-1����2NO2(g)![]() 2NO(g)+O2(g)����H��_____________kJ��mol-1
2NO(g)+O2(g)����H��_____________kJ��mol-1
(2)T��ʱ�����ò�ѹ���ڸ��Է�Ӧ���У�Ͷ��һ������NO2������Ӧ3NO2(g)![]() 3NO(g)��O3(g)����ϵ����ѹǿ p��ʱ�� t�ı仯���±���ʾ��
3NO(g)��O3(g)����ϵ����ѹǿ p��ʱ�� t�ı仯���±���ʾ��
��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
�������ͷ�Ӧ�¶ȣ���ƽ�����ϵѹǿ p______24.00 MPa(����>������<����������),ԭ����____________��
��15min ʱ����Ӧ���ת���� ��=______��
��T��ʱ��Ӧ3NO2(g)![]() 3NO(g)��O3(g)��ƽ�ⳣ��Kp=____________(Kp Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ������ѹ���Ը���������ʵ�������)
3NO(g)��O3(g)��ƽ�ⳣ��Kp=____________(Kp Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ������ѹ���Ը���������ʵ�������)
(3)T��ʱ�������Ϊ2L���ܱո��������У�Ͷ��2 mol NO2������Ӧ2NO2(g)![]() 2NO(g)��O2(g)��ʵ���ã�v��=k�� c2(NO2)��v��=k�� c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣���¶�ΪT��ʱNO2��ת������ʱ��仯�Ľ����ͼ��ʾ(��Ӧ��5.5minʱ�ﵽƽ��)��
2NO(g)��O2(g)��ʵ���ã�v��=k�� c2(NO2)��v��=k�� c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣���¶�ΪT��ʱNO2��ת������ʱ��仯�Ľ����ͼ��ʾ(��Ӧ��5.5minʱ�ﵽƽ��)��

�����������ĸ��������У�Ͷ��̶�����NO2������Ӧ��Ҫ���NO2ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______________��___________��
����ͼ�����ݣ�����÷�Ӧ��ƽ�ⳣ��Ϊ_________��
�ۼ���A �㴦v��/v��=_________________________(����1λС��)��