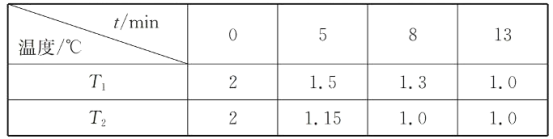
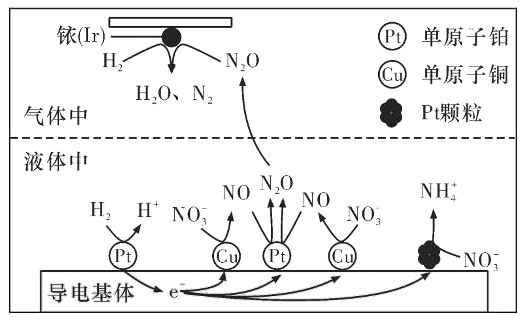
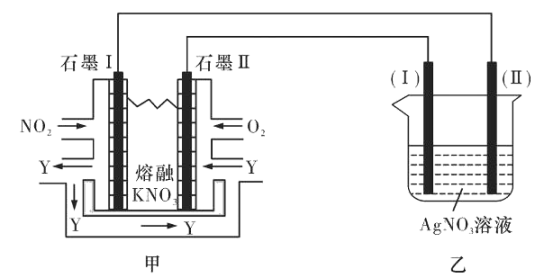
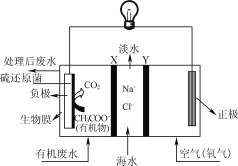
题目内容
【题目】(1)某学生用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL1mol/L的稀硫酸。其实验过程如下:
①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为_______;
②配制稀硫酸时所需要浓硫酸体积为_______mL,用_______量筒(“100 mL”或 “10 mL”)量取浓硫酸;
③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌;
④将____________的上述溶液沿玻璃棒注入100 mL的容量瓶中,并用50mL蒸馏水分2~3次洗涤烧杯,洗涤液也注入容量瓶中,并摇匀;
⑤加水至距刻度线1~2cm时,改用_____________加水,使溶液凹液面跟刻度相平。
(2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为__________(列出计算式即可)。(已知:浓硫酸的质量分数为98%,密度为1.84 g/cm3)
【答案】18.4mol/L 5.4mL 10 冷却至室温 胶头滴管 ![]()
【解析】
(1) ①根据公式:![]() 计算可知,此硫酸的浓度为18.4mol/L;
计算可知,此硫酸的浓度为18.4mol/L;
②若要配制0.1L1mol/L的稀硫酸,则需要H2SO4的量为0.1mol,即9.8g,所以需要质量分数98%的浓硫酸10g,根据公式:![]() ,计算可知需要浓硫酸的体积约为5.4mL,应当选择量程为10mL的量筒量取;
,计算可知需要浓硫酸的体积约为5.4mL,应当选择量程为10mL的量筒量取;
④浓硫酸稀释过程会放出大量的热,因此稀释后需要冷却至室温再可转移;
⑤定容阶段,液面距离刻度线2至3cm时,要改用胶头滴管加水定容;
(2)不妨假设浓硫酸的体积为1L,那么加水10L。混合过程中,溶质的总质量为:![]() ;溶液总质量为:
;溶液总质量为:![]() ,所以混合溶液的质量分数为:
,所以混合溶液的质量分数为:![]() 。
。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案【题目】下表为元素周期表的一部分,请参照给定元素的位置,回答下列问题:
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素④、⑤、⑥的原子半径由大到小的顺序为___(用元素符号表示)。
(2)元素③、⑦的最高价含氧酸的酸性由强到弱的顺序为__。(用化学式表示)
(3)碱性强弱比较:元素⑤的氢氧化物__⑥的氢氧化物(用<、=、>填空);两者相互反应的离子方程式为__。
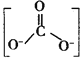
(4)由元素⑤和⑧共同组成的化合物的电子式为__、它属于__化合物。(填“共价”或“离子”)
(5)由元素①⑧形成的化合物A和由元素④⑤⑧的化合物B,可相互反应产生黄绿色气体单质,该反应的离子方程式为__;该黄绿色气体单质会使得湿润淀粉碘化钾试纸变蓝色,表明生成了碘单质(I2),由此推测这两种元的气态氢化物的稳定性强弱顺序为:__。(用化学式表示)