题目内容
【题目】钴的合金及其配合物用途非常广泛。已知Co3+比Fe3+的氧化性更强,在水溶液中不能大量存在。
(1)Co3+的核外电子排布式为__________________________。
(2)无水CoCl2的熔点为735℃、沸点为1049℃,FeCl3熔点为306℃、沸点为315℃。CoCl2属于_________晶体,FeCl3属于__________晶体。
(3)BNCP可用于激光起爆器等,可由HClO4、CTCN、NaNT共反应制备。
①![]() 的空间构型为______________。
的空间构型为______________。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_______{已知 ![]() 的结构式为
的结构式为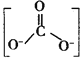 }。
}。
③NaNT可以![]() (双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(4)Co与CO作用可生成Co2(CO)8,其结构如图所示。该分子中C原子的杂化方式为_________________。
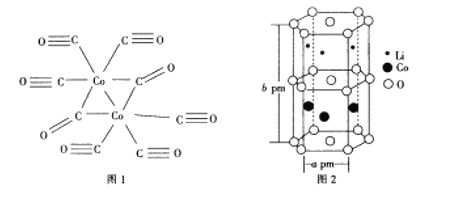
(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为___________。已知NA为阿伏加德罗常数的数值,则该晶胞的密度为__________(用含a、b、NA的代数式表示)g·cm-3。
【答案】[Ar]3d6或1s22s22p63s23p63d6 离子 分子 正四面体 N和O 9NA(或9×6.02×1023) sp和sp2 6 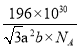
【解析】
(1)Co是27号元素,其原子核外有27个电子,失去3d上1个电子和4s上2个电子生成Co3+离子,根据构造原理知Co3+基态的电子排布式;
(2)分子晶体熔沸点较低,离子晶体熔沸点较高,据此解答;
(3)根据价层电子对互斥理论作答;
(4)根据图示Co2(CO)8的结构式结合杂化轨道理论作答;
(5)先通过数学几何关系计算出六棱柱的体积,再利用“均摊法”求出该晶胞中O原子、Li原子和Co原子的数目,最后利用晶体密度![]() =
=![]() 计算求出结论。
计算求出结论。
(1)Co位于第四周期第VIII族,基态Co的价电子排布式为3d74s2,Co3+核外电子排布式为 [Ar]3d6或1s22s22p63s23p63d6;
(2)无水CoCl2的熔点为735℃、沸点为1049℃,符合离子晶体的特点;FeCl3熔点为306℃、沸点为315℃,符合分子晶体的特点,则CoCl2属于离子晶体,FeCl3属于分子晶体;
(3)①ClO4-中心原子Cl有4个σ键,孤电子对数为(7+1-4×2)/2=0,价层电子对数为4,ClO4-的空间构型为正四面体;
②构成配位键,和中心原子提供空轨道,配原子提供孤电子对,根据CTCN的化学式,以及CO32-的结构式,与Co(III)形成配位键的原子是N和O;
③前一个C原子,有3个σ键,无孤电子对,杂化类型为sp2,后一个碳原子有2个σ键,无孤电子对,杂化类型为sp;成键原子之间只能形成一个σ键,即1mol该分子中含有σ键物质的量为9 mol,个数为9NA或9×6.02×1023。
(4)图中以碳氧双键存在的中心C原子是平面结构,C的价电子数=3+0=3,则采用sp2杂化方式;以碳氧三键存在的中心C原子是直线型结构,C的价电子数=2+0=2,则采用sp杂化方式,故答案为:sp和sp2;
题图中原子的堆积方式为六方最密堆积。1pm=1010cm,六棱柱底部正六边形的面积=6![]() (a×10-10)2cm2,六棱柱的体积=6
(a×10-10)2cm2,六棱柱的体积=6![]() (a×10-10)2(b×10-10)cm3=3
(a×10-10)2(b×10-10)cm3=3![]() a2b×10-30cm3。该晶胞中氧原子的数目为12
a2b×10-30cm3。该晶胞中氧原子的数目为12![]() +6
+6![]() +2
+2![]() +1=6,Li原子的数目为3,Co原子的数目为3,已知
+1=6,Li原子的数目为3,Co原子的数目为3,已知![]() 为阿伏加德罗常数的数值,则一个晶胞的质量为
为阿伏加德罗常数的数值,则一个晶胞的质量为![]() g,故密度为
g,故密度为![]() =
=![]() =
=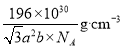 。
。
因此,本题正确答案是:![]()

 名校课堂系列答案
名校课堂系列答案【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D