题目内容
【题目】I.氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:

当Cl2与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为____kJ.
(2)在一个恒容密闭容器中究入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
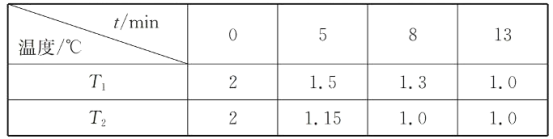
①T1________T2(填“>“”<”或”=”)。
②温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示
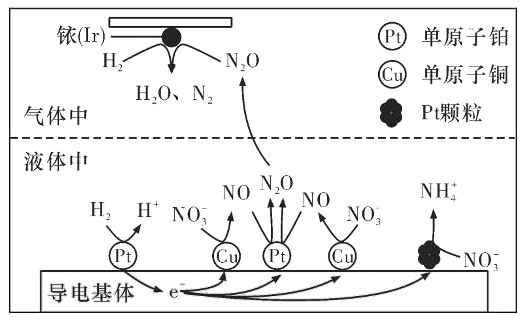
①Ir表面发生反应的方程式为_____________。
②若导电基体上的Pt颗粒增多,造成的后果是______________。
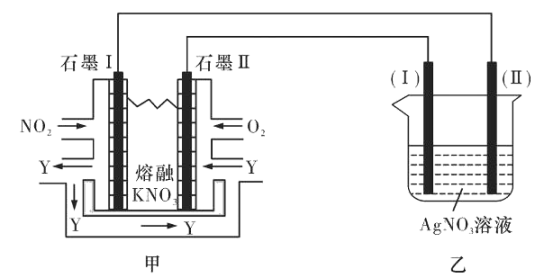
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
 请回答下列问题:
请回答下列问题:
(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为________。
②若用10A的电流电解60min后,乙中阴极得到32.4gAg,则该电解池的电解效率为____%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol)
【答案】277.5 < ![]() H2+N2O
H2+N2O![]() N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 80.4
N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 80.4
【解析】
(1)2NO(g)+Cl2(g)![]() 2ClNO(g),反应的焓变△H=反应物总键能-生成物总键能,据此计算;
2ClNO(g),反应的焓变△H=反应物总键能-生成物总键能,据此计算;
(2)①温度越高,反应速率越大,达到平衡状态所需要的时间短;
②用三段式法计算出平衡时各种成分的物质的量,根据压强比等于气体的物质的量的比,用每种物质的物质的量占总物质的量的百分比乘以总压强得该组分的分压,带入平衡常数表达式,可得Kp;
(3)①由原理的示意图可知,Ir的表面氢气和N2O发生反应生成N2和H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根。
(4)①石墨I上发生氧化反应,为原电池的负极,石墨II为原电池的正极,正极上发生还原反应;
②根据Ag的质量计算电子转移的物质的量,结合法拉第常数为96500C/mol及电流强度与通电时间可计算出电解池的电解效率。
(1)2NO(g)+Cl2(g)![]() 2ClNO(g),1molCl2参与反应发生焓变△H=243kJ/mol+2×630kJ/mol-2×(200kJ/mol+607kJ/mol)=-111kJ/mol,此时转移2mol电子,则有5mol电子转移时,热量变化为111kJ/mol×
2ClNO(g),1molCl2参与反应发生焓变△H=243kJ/mol+2×630kJ/mol-2×(200kJ/mol+607kJ/mol)=-111kJ/mol,此时转移2mol电子,则有5mol电子转移时,热量变化为111kJ/mol×![]() mol=277.5kJ;
mol=277.5kJ;
(2)①温度越高,反应速率越大,达到平衡状态所需要的时间短,根据表格数据可知在温度为T2时先达到平衡,所以反应温度T1<T2;
②起始物质的量为3mol,压强为p0,反应后各物质变化为
2NO+Cl2![]() 2ClNO
2ClNO
起始物质的量 2 1 0
达平衡物质的量 1 0.5 1
在恒容密闭容器中发生反应,气体的物质的量的比等于压强之比,反应后气体的总物质的量n(总)后=2.5mol,反应前气体的物质的量n(前)总=3mol,所以反应后压强为P=![]() P0=
P0=![]() P0;p(NO)=p(ClNO)=
P0;p(NO)=p(ClNO)=![]() ×
×![]() P0=
P0=![]() P0;p(Cl2)=
P0;p(Cl2)=![]() p(NO)=
p(NO)=![]() P0,则化学平衡常数Kp=
P0,则化学平衡常数Kp= =
=![]() ;
;
(3)①在Ir表面上H2与N2O反应产生N2和水,反应方程式为H2+N2O![]() N2+H2O;
N2+H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根,不利于降低溶液中含氮量;
(4)①根据图示可知在石墨I上NO2失去电子发生氧化反应转化为N2O5,为原电池的负极,石墨II上O2获得电子,与溶液中的N2O5结合形成NO3-,发生还原反应,为原电池的正极,电极反应式为:O2+4e-+2N2O5=4NO3-;
②n(Ag)=![]() =0.3mol,由于每反应产生1molAg,转移1mol电子,则转移的电量为Q=0.3mol×96500C/mol=28950C,由于电流强度为10A,电解时间为60min,转移的总电量Q总=10×60×60C=36000C,所以电解池的电解效率=
=0.3mol,由于每反应产生1molAg,转移1mol电子,则转移的电量为Q=0.3mol×96500C/mol=28950C,由于电流强度为10A,电解时间为60min,转移的总电量Q总=10×60×60C=36000C,所以电解池的电解效率=![]() ×100%=80.4%。
×100%=80.4%。






