题目内容
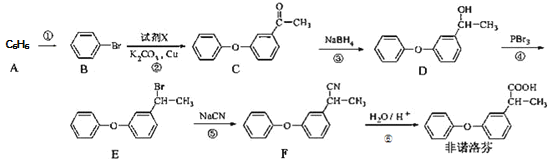
【题目】某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
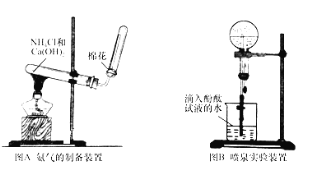
(1)根据图A写出实验室制取氨气的化学方程式_____;
(2)收集氨时,试管口棉花的作用_____;验满的方法是_____;收集干燥的氨时,使用的干燥剂是_____;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是_____.
A、氢气 B、氧气 C、氯气 D、二氧化碳
(4)图B装置进行喷泉实验,烧瓶中充满氨气,引发水上喷的操作是_____;所得溶液呈_____性 (填“酸”、“碱”或“中” ),解释原因 (用化学方程式表示 )_____。
【答案】2NH4Cl+Ca (OH )2![]() 2NH3↑+CaCl2+2H2O 防止与空气对流收集不到纯净的氨气 将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝 (或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟 ) 碱石灰 B 打开止水夹,挤出胶头滴管中的水 碱 NH3+H2ONH3H2ONH4++OH﹣
2NH3↑+CaCl2+2H2O 防止与空气对流收集不到纯净的氨气 将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝 (或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟 ) 碱石灰 B 打开止水夹,挤出胶头滴管中的水 碱 NH3+H2ONH3H2ONH4++OH﹣
【解析】
(1)实验室通常用加热氢氧化钙与氯化铵的混合固体的方法制取氨气;(2)根据氨气的溶解性及密度确定氨气的收集方法;氨气有刺激性气味,能污染大气;氨气的水溶液显碱性;(3)根据实验室制取氨气选择固固加热装置,结合气体的反应原理来分析试剂和使用的仪器,从而确定装置;(4)氨气极易溶于水,形成压强差可以形成喷泉;据此分析解答。
(1)氨盐和碱反应生成氨气和水,实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,所以不能采用排水法收集氨气,氨气的密度小于空气且常温下和氧气不反应,根据装置图知,氨气采用向下排空气法收集;氨气有刺激性气味,能污染大气,为防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气,用棉花塞在试管口,检验氨气是否集满,可以利用氨气的水溶液显碱性,即用“使湿润的红色石蕊试纸变蓝”;也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟”,碱石灰是固体氢氧化钠和氧化钙的混合物,氨气不能与碱石灰反应,且碱石灰能吸水,所以用碱石灰作干燥剂,故答案为:防止与空气对流收集不到纯净的氨气;将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝(或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟);碱石灰;
(3)实验室制取氨气,用的是固体与固体反应,需要加热,应该使用硬质大试管作反应器。A、实验室制取氢气,是用锌与稀硫酸反应,不需要加热,故A不选;B、实验室制取氧气,可以用加热氯酸钾(用二氧化锰作催化剂)或高锰酸钾的方法,要使用加热固体反应物的装置,可以使用硬质大试管作反应器,故B选;C、实验室制取氯气用浓盐酸与二氧化锰固体反应,需要加热,属于固液加热,使用分液漏斗和烧瓶,故C不选;D、实验室制取二氧化碳,用的是碳酸钙与稀盐酸反应,不需要加热,故D不选;因此实验室制取氧气和氨气的实验装置相同,故答案为:B;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,氨气和水反应生成一水合氨,反应为:NH3+H2ONH3H2O,一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子,电离方程式为NH3H2ONH4++OH-,溶液呈碱性,故答案为:打开止水夹,挤出胶头滴管中的水;碱;NH3+H2ONH3H2ONH4++OH-。