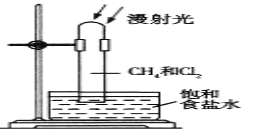
题目内容
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是__,基态镍原子的价电子的电子排布图为__。
(2)C、N、O的第一电离能由大到小的顺序为__。
(3)SO2分子的VSEPR构型为__;SO3分子中心原子的杂化形式为__;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_,分子中的σ键和π键数目之比是__。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键__(填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是__。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为___,属于__晶体。
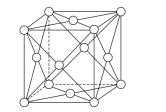
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___g/cm3(列出计算式)。
【答案】第五周期VIII族 ![]() N>O>C 平面三角形 sp2 直线形 1:1 不是 H2O和NO 0价 分子
N>O>C 平面三角形 sp2 直线形 1:1 不是 H2O和NO 0价 分子 ![]()
【解析】
(1)钯和镍同列,钯在镍的下一周期,镍位于第四周期10列,进行分析判断;
(2)同周期从左向右第一电离能逐渐增大,但ⅡA>ⅢA,ⅤA>ⅥA,从而得出结果;
(3)推断VSEPR模型,采用价层电子对数=σ键+孤电子对数分析;杂化轨道数等于价层电子对数,分析SO3中S的杂化类型;等电子体具有相同的空间结构和相同的化学键类型,据此分析;
(4)依据大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键分析;根据配合物的组成进行分析;
(5)CO整体不带电,因此推出Fe(CO)5中铁元素的化合价为0,Fe(CO)5熔沸点较低,属于分子晶体;
(6)钯位于顶点和面心,个数为4,利用微粒个数与物质的量关系,计算出晶胞的物质的量,从而求出晶胞的质量,根据边长计算出晶胞的体积,最后依据密度的定义,求出密度;
(1)钯与镍位于同列,在镍的下一周期,镍位于第四周期VIII族,则钯位于第五周期VIII族;镍属于过渡元素,其价电子排布式为3d84s2,则价电子排布图为![]() ;
;
(2)C、N、O位于同周期,同周期从左向右第一电离能逐渐增大,但ⅡA>ⅢA,ⅤA>ⅥA,三种元素的第一电离能大小顺序是N>O>C;
(3)价层电子对数=σ键+孤电子对数=2+![]() =3,因此SO2的VSEPR模型为平面三角形;SO3的价层电子对数为3,价层电子对数等于杂化轨道数,即中心原子S的杂化类型为sp2;等电子体具有相同的空间结构和相同的化学键类型,CO2与N2O为等电子体,CO2为直线形,则N2O的空间构型为直线形;CO2的空间构型为O=C=O,σ键和π键数目之比为1:1,即N2O中σ键和π键数目之比为1:1;
=3,因此SO2的VSEPR模型为平面三角形;SO3的价层电子对数为3,价层电子对数等于杂化轨道数,即中心原子S的杂化类型为sp2;等电子体具有相同的空间结构和相同的化学键类型,CO2与N2O为等电子体,CO2为直线形,则N2O的空间构型为直线形;CO2的空间构型为O=C=O,σ键和π键数目之比为1:1,即N2O中σ键和π键数目之比为1:1;
(4)根据形成大π键是3个或3个以上原子,而NO只有2个原子,因此题中3电子π键不是大π键;[Fe(H2O)5NO]2+是配合离子,因此H2O和NO是配位体;
(5)CO整体不带电,则Fe(CO)5中铁元素的化合价为0价;Fe(CO)5熔点为-20℃,沸点为103℃,熔沸点较低,Fe(CO)5属于分子晶体;
(6)钯原子位于顶点和面心,个数为![]() =4,晶胞的质量为
=4,晶胞的质量为![]() ,晶胞的体积为(a×10-10)3cm3,则晶胞的密度是
,晶胞的体积为(a×10-10)3cm3,则晶胞的密度是![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。