题目内容
1.在10mL物质的量浓度为2mol•L-1的盐酸中加入0.65g锌片,它们恰好完全反应,生成氢气的体积为0.224L(标准状况下).请分析下面表格.| 化学反应 | Zn+2HCl═ZnCl2+H2↑ | |||
| Zn | HCl | ZnCl2 | H2 | |
| 质量或气体体积 | 0.65g | 0.73gg | 1.36g | 0.224L |
| 物质的量 | ||||
| 物质的量之比 | ||||
| 微粒数 | ||||
| 结论:化学方程式中反应物或生成物化学式前的系数之比等于它们的 之比 | ||||
分析 根据n(HCl)=cV计算物质的量,再求出质量,根据反应方程式Zn+2HCl═ZnCl2+H2↑ 计算.
解答 解:在10mL物质的量浓度为2mol•L-1的盐酸中加入0.65g锌片,n(HCl)=cV=0.01L×2mol/L=0.02mol,则m(HCl)=nM=0.02mol×36.5g/mol=0.73g,
Zn+2HCl═ZnCl2 +H2↑
65 73 136
0.65g 0.73g xg
x=$\frac{136×0.65g}{65}$=1.36g,
n(Zn)=$\frac{0.65g}{65g/mol}$=0.01mol,n(HCl)=0.02mol,n(ZnCl2)=$\frac{1.36g}{136g/mol}$=0.01mol,n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol;
则n(Zn):n(HCl):n(ZnCl2):n(H2)=1:2:1:1;
Zn、HCl、ZnCl2、H2的微粒数分别为0.01NA、0.02NA、0.01NA、0.01NA,
则化学方程式中反应物或生成物化学式前的系数之比等于它们的物质的量之比
| 化学反应 | Zn+2HCl═ZnCl2+H2↑ | |||
| Zn | HCl | ZnCl2 | H2 | |
| 质量或气体体积 | 0.65g | 0.73gg | 1.36g | 0.224L |
| 物质的量 | 0.01mol | 0.02mol | 0.01mol | 0.01mol |
| 物质的量之比 | 1:2:1:1 | |||
| 微粒数 | 0.01NA | 0.02NA | 0.01NA | 0.01NA |
| 结论:化学方程式中反应物或生成物化学式前的系数之比等于它们的物质的量之比 | ||||
| 化学反应 | Zn+2HCl═ZnCl2+H2↑ | |||
| Zn | HCl | ZnCl2 | H2 | |
| 质量或气体体积 | 0.65g | 0.73gg | 1.36g | 0.224L |
| 物质的量 | 0.01mol | 0.02mol | 0.01mol | 0.01mol |
| 物质的量之比 | 1:2:1:1 | |||
| 微粒数 | 0.01NA | 0.02NA | 0.01NA | 0.01NA |
| 结论:化学方程式中反应物或生成物化学式前的系数之比等于它们的物质的量之比 | ||||
点评 本题考查了物质的量的有关计算、有关方程式的计算,题目难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
9.下列有关化学用语表示正确的是( )
| A. | 氯化钠的分子式:NaCl | |
| B. | 氢氧根离子的电子式: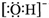 | |
| C. | 氯原子的结构示意图: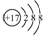 | |
| D. | 中子数为146、质子数为92的铀(U)原子14692U |
16.下列说法符合事实的是( )
| A. | SiO2溶于水成为硅酸 | |
| B. | CO2通入水玻璃中得到白色沉淀 | |
| C. | CO2通入饱和CaCl2溶液能生成白色沉淀 | |
| D. | 硅酸酸性比碳酸弱,所以SiO2不能跟Na2CO3反应 |
11.铝与热水反应速率很慢,加入氢氧化钠溶液,可大大加快反应速率的原因是( )
| A. | 氢氧化钠起催化作用 | B. | 氢氧化钠使温度升高 | ||
| C. | 氢氧化钠作用掉氢氧化铝 | D. | 氢氧化钠作用掉氧化铝 |
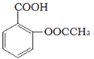 乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药,其结构简式如图所示.
乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药,其结构简式如图所示.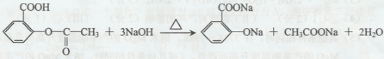 .
. .
.