题目内容
9.下列有关化学用语表示正确的是( )| A. | 氯化钠的分子式:NaCl | |
| B. | 氢氧根离子的电子式: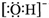 | |
| C. | 氯原子的结构示意图: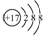 | |
| D. | 中子数为146、质子数为92的铀(U)原子14692U |
分析 A.氯化钠晶体为离子晶体,不存在氯化钠分子;
B.氢氧根离子为带有1个负电荷的阴离子,电子式中需要标出最外层电子及所带电荷;
C.氯原子的核电荷数=核外电子总数=17,最外层为7个电子;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.NaCl为氯化钠的化学式,氯化钠不存在分子式,故A错误;
B.氢氧根离子为阴离子,其电子式为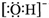 ,故B正确;
,故B正确;
C.氯原子的核外电子总数为17,其正确的原子结构示意图为: ,故C错误;
,故C错误;
D.中子数为146、质子数为92的铀(U)原子的质量数为238,其正确的表示方法为:92238U,故D错误;
故选B.
点评 本题考查了常见化学用语的书写方法,题目难度中等,涉及电子式、原子结构示意图、化学式与分子式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
19.下列各组元素中,属于同一主族的是( )
| A. | S、Cl | B. | Na、K | C. | N、O | D. | F、Mg |
20.隔绝空气、加热条件下金属钠在二氧化碳气体中能够剧烈燃烧,根据你学到的化学知识判断金属钠在二氧化碳气体中燃烧时,其产物中最不可能产生的物质是( )
| A. | Na2O | B. | C | C. | Na2O2 | D. | Na2CO3 |
17.NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 46g NO2和N2O4的混合气体含有3NA个原子 | |
| B. | 标准状况下,22.4 L空气含有NA个单质分子 | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na-的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
4.恒容密闭的烧瓶里盛放气体M,在25℃时建立如下平衡:2M(g)?N(g),把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是( )
| A. | 平均相对分子质量 | B. | 密度 | ||
| C. | 容器内的压强 | D. | 物质的量 |
14.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | 该反应中,热能转化为产物内部的能量 | |
| B. | NH4HCO3和盐酸的反应是放热反应 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H=+akJ•mol-1 |
1.在10mL物质的量浓度为2mol•L-1的盐酸中加入0.65g锌片,它们恰好完全反应,生成氢气的体积为0.224L(标准状况下).请分析下面表格.
| 化学反应 | Zn+2HCl═ZnCl2+H2↑ | |||
| Zn | HCl | ZnCl2 | H2 | |
| 质量或气体体积 | 0.65g | 0.73gg | 1.36g | 0.224L |
| 物质的量 | ||||
| 物质的量之比 | ||||
| 微粒数 | ||||
| 结论:化学方程式中反应物或生成物化学式前的系数之比等于它们的 之比 | ||||
18.对于电解质溶液,下列说法正确的是( )
| A. | 甲基橙显黄色的溶液中,不可能有:Mg2+、K+、SO42-、NO3- | |
| B. | 无色溶液中还大量含有:Al3+、K+、SO32-、ClO- | |
| C. | Fe(OH)3溶于氢碘酸发生的反应为:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 在稀氨水中通入过量CO2发生的反应为:NH3•H2O+CO2═NH4++HCO3- |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=0的溶液:Na+、Fe2+、SO42-、MnO4- | |
| B. | 加入淀粉变蓝的溶液:K+、NH4+、SO32-、Cl- | |
| C. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液:K+、Cl-、NO3-、SO42- | |
| D. | 能溶解Al(OH)3的溶液:Na+、Mg2+、HCO3-、SO42- |