题目内容
由正丁醇(用n?C4H9OH表示)制备正溴丁烷(沸点:101.6 ℃)的反应如下:n?C4H9OH+NaBr+H2SO4―→n?C4H9Br+NaHSO4+H2O
副反应:n?C4H9OH CH3CH2CHCH2↑+H2O
CH3CH2CHCH2↑+H2O
2n?C4H9OH (n?C4H9)2O+H2O
(n?C4H9)2O+H2O
3H2SO4(浓)+2NaBr(固)=2NaHSO4+Br2↑+SO2↑+2H2O
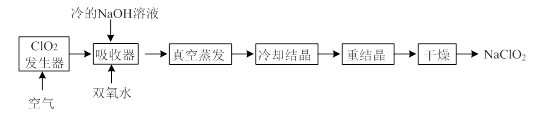
已知反应物及其用量:固体NaBr 0.24 mol,n?C4H9OH 0.20 mol,浓H2SO4 29 mL,H2O 20 mL。
制备过程经历如下五个步骤,试回答下列问题:
(1)投料:在圆底烧瓶中加入20 mL水,再慢慢加入29 mL浓硫酸,混合均匀并冷却至室温后,再依次加入0.20 mol正丁醇(约18 mL)和0.24 mol溴化钠,充分振荡后加入几粒沸石。
①冷却至室温后再加正丁醇和溴化钠的目的是________。
| A.减少HBr的挥发 |
| B.防止正丁醇的挥发 |
| C.防止溴化钠被氧化 |
| D.防止温度过高导致炭化结焦 |
_____________________________________________________。
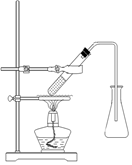
(2)加热回流:反应装置选择Ⅱ而不选择Ⅰ的原因是_________________。在反应装置中冷凝水应该从________(填“A”或“B”)端进水。

(3)分离粗产物:反应结束待反应液冷却后,用直形冷凝管换下球形冷凝管,将其变为蒸馏装置进行蒸馏,得到的粗产物中除主产品外,还含下列选项中的________。
①C4H9OH ②SO2 ③(C4H9)2O ④Br2 ⑤NaHSO4 ⑥H2O ⑦H2SO4
(4)洗涤粗产物:将馏出液移至分液漏斗中,加入等体积的水洗涤后,分液得有机层。如果不能判断哪层是有机层,可以用_______________方法来判断。对有机层,进行洗涤除杂、除水后可得到粗产品。
(5)收集产物:将干燥好的产物移至小蒸馏瓶中,加热蒸馏,收集99~103 ℃的馏分。要证明最终产物是n?C4H9Br,方法是_____________________________
___________________________________________。
(1)①ABC ②会加大副反应进行
(2)Ⅱ可以防止挥发性尾气进入空气污染环境 B (3)①③④⑥
(4)从任意一层取少量溶液加水,如混溶则该层为水层;不混溶则为有机层(其他合理答案也给分)
(5)测定产品的沸点(其他合理答案也给分)
解析

 出彩同步大试卷系列答案
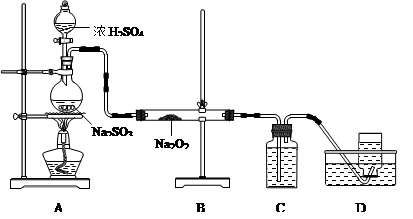
出彩同步大试卷系列答案某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。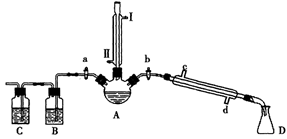
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
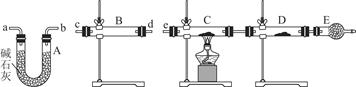
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: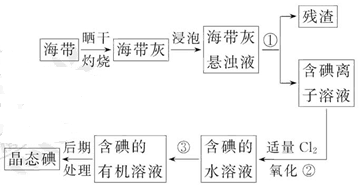
(1)步骤①的实验操作名称是_________;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是_________;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是_________;
| A.CCl4与水不互溶 |
| B.CCl4可与I2发生取代反应 |
| C.CCl4的密度比水大 |
| D.CCl4不易燃烧,可作灭火剂 |
(4)步骤③中还可选择_________作萃取剂;
(5)步骤②中反应的离子方程式是__________________________________;
(6)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:_________。
Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和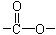 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯( )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| | 熔点 ℃ | 沸点 ℃ | 水溶性 |
| 甲醇 | —97.8 | 64.7 | 易溶 |
| 苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
| 苯甲酸甲酯 | —12.3 | 198 | 难溶 |
合成苯甲酸甲酯的流程如下:

请回答下列问题:
(1)温度①约为_________℃,操作③为_________,操作④为__________。
(2)第②步加热的目的是______________________________________。
(3)选择合适的制备苯甲酸甲酯的装置:______________。



A B C D
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式_______。①为芳香化合物 ②含有醛基 ③能与金属Na反应
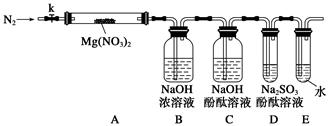
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
(2)为了确定产物,进行以下定性实验:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧, 火焰呈淡蓝色 | 气体成分为 ① |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② | ③ | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- 离子 |
实验Ⅲ中洗涤的操作方法是 。
(3)为进一步确定实验I的白色不溶物的成分,进行以下定量实验,装置如图所示:

称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
装置C的作用是 ;
白色不溶物的化学式为 。
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式 。