题目内容
20.化学理论在元素单质及其化合物反应中应用广泛.(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c(填序号)

(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
①该反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和COg)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1=W2(填“>”、“<”或“=”).
分析 (1)①增大压强,平衡向着方程式的系数减小的方向移动;
②升高温度,化学平衡向着吸热方向进行;
(2)据通过加热引发铝热反应以及铝热反应为放热反应以及温度升高化学反应速率加快;
(3)①根据温度和平衡常数以及反应的吸放热之间的关系来回答;
②计算1000℃时CO的转化率以及二氧化碳的平衡浓度,根据三行式计算比较.
解答 解:(1)mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向方式的系数减小的方向移动,即向正反应方向移动,则m>n+p,故答案为:大于;
②其他条件不变,升高温度,化学平衡向着吸热方向进行,即加热后A的质量减小,则反应正向进行,△H>0,故答案为:大于;
(2)因通过加热引发铝热反应,所以开始速率为零,一旦反应,反应放热,温度不断升高,化学反应速率加快,故选:c;
(3)①该反应的K随着温度的升高而减小,所以反应释放热量,△H<0,故答案为:<;
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,
FeO(s)+CO(g)?Fe(s)+CO2(g)
初始浓度:0.3 0.3 0 0
变化浓度:0.15 0.15
平衡浓度:0.15 0.15
CO转化率为W1=$\frac{0.15}{0.3}$×100%=20%,c(CO2)=0.15mol•L-1,K=1,
T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,设变化的CO浓度是x,
FeO(s)+CO(g)?Fe(s)+CO2(g)
初始浓度:0.3 0.3 0 0
变化浓度:x x
平衡浓度:0.3-x x
则K=$\frac{x}{0.3-x}$=0.68,解得x=0.12mol/L,所以CO转化率为W2=$\frac{0.12}{0.3}$×100%=40%,c所以T℃时CO的转化率大于1000℃时CO的转化率,升高温度,化学平衡向着吸热方向进行,△H<0,所以温度T低于1000,此时保持其它条件不变再充入2.0mol CO(g),则建立的平衡是等效的,所以再达平衡时测得CO转化率为W2=W1,故答案为:低于;=.
点评 本题是一道关于化学平衡常数的计算题,考查生化学平衡移动原理以及三行式的计算知识,属于综合知识的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 0.1mol/L Na2SO4溶液中,Na+的物质的量浓度为 0.1mol/L | |
| B. | “物质的量”是国际单位制中的一个基本单位 | |
| C. | 22.4L任何气体的物质的量均为1mol | |
| D. | 0.2mol由H2、O2、N2和CO2组成的混合气体在标准状况下的体积约为4.48L |
| A. | 该反应中氮元素被氧化 | |
| B. | 该反应中H2O2作还原剂 | |
| C. | 实验室配制NaCN溶液时,需加入适量的NaOH溶液 | |
| D. | 0.1mol•L-1NaCN溶液中含HCN和CN-总数目为0.1×6.02×1023 |
 黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )| A. | 黄曲霉毒素M1的分子式为C17H14O7 | |
| B. | 黄曲霉毒素M1含有羟基,此羟基能被催化氧化为醛基 | |
| C. | 1mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2molNaOH | |
| D. | 1mol黄曲霉毒素M1最多能与7molH2发生加成反应 |
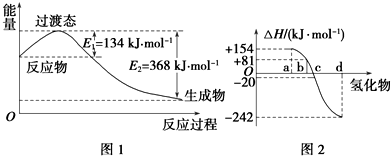
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)
△H=-185kJ•mol-1
请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 432 |
③图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定
a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)
△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)
△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.

