题目内容
【题目】现有如下描述
①冰的密度小于水,液态水中含有(H2O)n都是由于氢键所致
②不同种元素组成的多原子分子里的键一定都是极性键
③离子键就是阳离子、阴离子的相互引力
④用电子式表示MgCl2的形成过程:![]()
⑤H2分子和Cl2分子的反应过程就是H2、Cl2分子里的共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述说法正确的是( )
A. ①②③④⑤ B. ①② C. ④ D. ①
【答案】D
【解析】①冰和水的密度不同主要是由于水分子间存在氢键,氢键在水液态时使一个水分子与4个水分子相连,形成缔合物;
②不同种元素组成的多原子分子里可存在极性键、非极性键;
③离子键就是阴、阳离子间的静电作用,包括引力和排斥力;
④用电子式表示MgCl2的形成过程之间用箭头而不是等于号;
⑤H原子、Cl原子形成共价键。
①冰的密度小于水,液态水中含有(H2O)n都是由于氢键所致,正确;
②不同种元素组成的多原子分子里可存在极性键、非极性键,如H-O-O-H分子中含极性键、非极性键,错误;
③离子键就是阴、阳离子间的静电作用,包括引力和排斥力,错误;
④用电子式表示MgCl2的形成过程之间用箭头而不是等于号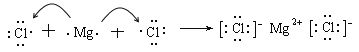 ,错误;
,错误;
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成共价键,H、Cl原子之间以共用电子对形成共价键,错误;
答案选D。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目