��Ŀ����
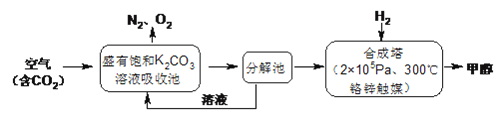
����Ŀ�������ѧ���������ɫ���ɡ����롣�Ѻ��д���CO2�Ŀ�������K2CO3��Һ�У��ٰ�CO2����Һ����ȡ��������ʹ֮��H2��Ӧ���ɿ�������Դ�״����乤����������ͼ��ʾ��
�ش��������⣺
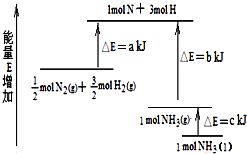
(1)����ֽ������Ҫ������______���ںϳ����У���������H2��CO2��Ӧ������4.4gCO2��������̬��H2O��CH3OH���ɷų�5370J��������д���÷�Ӧ���Ȼ�ѧ����ʽ________��
(2)�ù�������Щ���������ˡ���ɫ���ɡ������еġ���ɫ���� ��_______����_______��
(3)һ�������£���2L�����ܱ������г���1.0molCO2��3.0mol H2���ڲ�ͬ���������£���ͬʱ����CO2��ת�������¶ȱ仯��ͼ��ʾ��
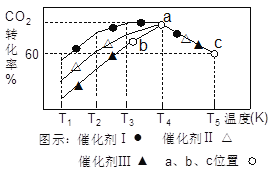
�ٴ���Ч����ѵ���_______�������I����������������������b��v������______v���棩���>������<������=������
�ڴ˷�Ӧ��a��ʱ�Ѵ�ƽ��״̬��a���ת���ʱ�c��ߵ�ԭ����_________��c��ʱ�÷�Ӧ��ƽ�ⳣ��K=___________(����һλС��)��
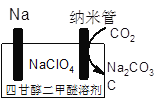
(4)��ѧ�һ��о����������������������أ���ͼΪ�����о���Na��CO2�ɳ����ʾ��ͼ����װ�÷ŵ�ʱ���ܷ�Ӧ����ʽΪ_________��
(5)��֪25��ʱH2CO3�ĵ���ƽ�ⳣ��Ϊ��Kal =4.4��10��7��Ka2 =4.7��l0��ll����Ӧ��HCO3��+H2O![]() H2CO3+ OH����ƽ�ⳣ��K=________��
H2CO3+ OH����ƽ�ⳣ��K=________��
���𰸡� KHCO3����̼����أ� CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ��H����53.7kJ/mol ���ٴ�����CO2�����������ԴCH3OH�� K2CO3��ѭ�����ã���������ѭ�����ã���̼���õ� ������ �� �÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ� K��2.1 4Na+3CO2==2Na2CO3+C K��2.3��10��8
H2O(g)+CH3OH(g) ��H����53.7kJ/mol ���ٴ�����CO2�����������ԴCH3OH�� K2CO3��ѭ�����ã���������ѭ�����ã���̼���õ� ������ �� �÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ� K��2.1 4Na+3CO2==2Na2CO3+C K��2.3��10��8
����������1������CO2�������Լ��Ȼ�ѧ��Ӧ����ʽ����д�����ճ��з���K2CO3��CO2��H2O=2KHCO3����˽���ֽ���е���Ҫ������KHCO3��H2��CO2��Ӧ�Ļ�ѧ����ʽΪ3H2��CO2=CH3OH��H2O������1molCO2���ų�������Ϊ5370��10��3/0.1kJ=53.70kJ�����Ȼ�ѧ����ʽΪ CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ��H����53.7kJ/mol ����2��������ɫ��ѧ��CO2��������ЧӦ���˷�Ӧ����CO2�����Լ��ٴ����е�CO2��CH3OHΪ�����Դ����3��������������ԭ������ѧƽ�ⳣ���ļ��㣬�ٸ���ͼ����I�Ĵ�Ч����ѣ�a��ת������ߣ�˵����ѧ��Ӧ�ﵽƽ�⣬b�㷴Ӧ������Ӧ������У���v��>v�棻�ڴ˷�Ӧ�Ƿ��ȷ�Ӧ���ﵽƽ��������¶ȵ����ߣ�ƽ�����淴Ӧ������У�CO2��ת���ʽ��ͣ�ԭ���Ǹ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
H2O(g)+CH3OH(g) ��H����53.7kJ/mol ����2��������ɫ��ѧ��CO2��������ЧӦ���˷�Ӧ����CO2�����Լ��ٴ����е�CO2��CH3OHΪ�����Դ����3��������������ԭ������ѧƽ�ⳣ���ļ��㣬�ٸ���ͼ����I�Ĵ�Ч����ѣ�a��ת������ߣ�˵����ѧ��Ӧ�ﵽƽ�⣬b�㷴Ӧ������Ӧ������У���v��>v�棻�ڴ˷�Ӧ�Ƿ��ȷ�Ӧ���ﵽƽ��������¶ȵ����ߣ�ƽ�����淴Ӧ������У�CO2��ת���ʽ��ͣ�ԭ���Ǹ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g)
H2O(g)+CH3OH(g)
��ʼ�� 1 3 0 0
�仯�� 0.6 1.8 0.6 0.6
ƽ�⣺ 0.4 1.2 0.6 0.6 ���ݻ�ѧƽ�ⳣ���Ķ���K=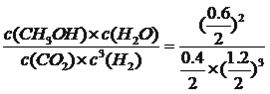 =2.1����4������缫��Ӧʽ����д������װ��ͼ��������ӦʽΪNa��e��=Na����������ӦʽΪ3CO2��4e��=2CO32����C����ʽ��ӵõ�4Na��3CO2=2Na2CO3��C����5������ƽ�ⳣ��������ƽ�ⳣ���Ķ��壬K=
=2.1����4������缫��Ӧʽ����д������װ��ͼ��������ӦʽΪNa��e��=Na����������ӦʽΪ3CO2��4e��=2CO32����C����ʽ��ӵõ�4Na��3CO2=2Na2CO3��C����5������ƽ�ⳣ��������ƽ�ⳣ���Ķ��壬K=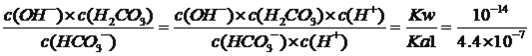 =2.3��10��8��
=2.3��10��8��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�