题目内容
【题目】在15mL0.1molL﹣1KOH溶液中逐滴加入0.2molL﹣1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( ) 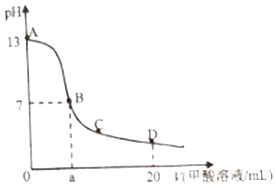
A.在B点:c(K+)=c(HCOO﹣)>c(OH﹣)=c(H+),且a=7.5
B.在A,B间任意一点,c(HCOO﹣)>c(K+)>c(OH﹣)>c(H+)
C.在D点:c(HCOO﹣)+c(HCOOH)>2c(K+)
D.B→C段:水的电离程度先增大后减小
【答案】C
【解析】解:A.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,反应生成甲酸钠溶液,溶液显示碱性,若溶液为中性,则c(OH﹣)=c(H+),根据电荷守恒c(K+)=c(HCOO﹣),由于溶液中存在部分甲酸,则应该满足a>7.5,故A错误;
B.在A、B间任意一点,因为开始时c(OH﹣)>c(HCOO﹣),即有可能存在:c(K+)>c(OH﹣)>c(HCOO﹣)>c(H+),故B错误;
C.D点甲酸过量,所加入甲酸的物质的量为:0.02L×0.2mol/L═0.004mol,KOH的物质的量为:0.015L×0.1mol/L=0.0015mol,根据物料守恒,则反应后溶液中一定满足:c(HCOO﹣)+c(HCOOH)>2c(K+),故C正确;
D.B点是甲酸钾和甲酸的混合溶液,在C点甲酸过量,溶液呈酸性,抑制水的电离,酸浓度增大水电离程度减小,故D错误;
故选C.

练习册系列答案
相关题目





